Hvad er den molekylære geometri af CS2?
Her er hvorfor:
* Centralatom: Carbon (c) er det centrale atom.
* Valenselektroner: Carbon har 4 valenselektroner, og svovl har 6 valenselektroner hver.
* binding: Kulstof danner dobbeltbindinger med hvert svovlatom ved hjælp af to af dets valenselektroner for hver binding.
* Elektronpar: Dette efterlader ingen ensomme par elektroner på carbonatomet.
* VSEPR -teori: I henhold til VSEPR (Valence Shell Electron Pair Repulsion) teori, vil elektronparene omkring det centrale atom arrangere sig selv at minimere frastødning. I dette tilfælde, med to bindingspar og ingen ensomme par, er det mest stabile arrangement lineært med svovlatomerne på modsatte sider af carbonatomet.
Derfor er den molekylære geometri af CS₂ lineær med en bindingsvinkel på 180 grader.
 Varme artikler
Varme artikler
-
 Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li
Fremtiden for biobrændstoffer i mørketLab-dyrkede alger. Kredit:Elizabeth Hann/UCR Alger kunne konkurrere med petroleum som fremtidens brændstof, hvis blot processen med at dyrke det var mere effektiv. Takket være et stipendium fra Li -
 Ny smart sensor kan revolutionere kriminalitet og forebyggelse af terrorismeForbrydelse, forebyggelse af terrorisme, miljøovervågning, genanvendelig elektronik, medicinsk diagnostik og fødevaresikkerhed, er blot nogle få af de vidtrækkende områder, hvor en ny kemikaliesensor
Ny smart sensor kan revolutionere kriminalitet og forebyggelse af terrorismeForbrydelse, forebyggelse af terrorisme, miljøovervågning, genanvendelig elektronik, medicinsk diagnostik og fødevaresikkerhed, er blot nogle få af de vidtrækkende områder, hvor en ny kemikaliesensor -
 Plastik og holdbarhedens forbandelseHver dag, vi producerer enorme mængder affald, og en stor del af den består af plastik. Dette meget holdbare materiale ender i vores oceaner. Det er ikke uden konsekvenser for vores oceaner og dets in
Plastik og holdbarhedens forbandelseHver dag, vi producerer enorme mængder affald, og en stor del af den består af plastik. Dette meget holdbare materiale ender i vores oceaner. Det er ikke uden konsekvenser for vores oceaner og dets in -
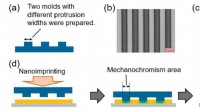 Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp
Forskning afslører kvantitative og højopløselige trykfunktioner af trykfølsomt materiale(a) Tværsnitsbillede af to siliciumforme. (b) Fotografier af en storskala siliciumform. (c) AFM billede af en smal skala silicium form. (d) Illustration til undersøgelse af rumlig opløsning ved hjælp
- Tuning reaktionsbarrierer for kuldioxid elektroreduktion til multicarbon produkter
- Årsager til cytoplasmisk streaming
- Hvordan kan du beskrive bevægelsen af et objekt?
- Hvad er gasserne i atmosfæren?
- Forskere identificerer gener, der adskiller pattedyr fra andre dyr
- Hvis momentum og masse får, hvordan man finder hastighed?


