Forskel mellem de forskellige former for kloratom?
1. Isotoper:
* klor-35 (³⁵cl): Dette er den mest rigelige isotop, der udgør ca. 75,77% af naturligt forekommende klor. Det har 17 protoner og 18 neutroner.
* chlor-37 (³⁷cl): Denne isotop er mindre rigelig, hvilket udgør ca. 24,23% af naturligt forekommende klor. Det har 17 protoner og 20 neutroner.
Nøgleforskelle mellem isotoper:
* Masse: Chlor-37 er tungere end klor-35 på grund af de to ekstra neutroner.
* nuklear stabilitet: Begge isotoper er stabile og ikke-radioaktive.
* Kemiske egenskaber: Begge isotoper udviser identiske kemiske egenskaber. Deres forskelle i masse er ubetydelige i de fleste kemiske reaktioner.
2. Ioner:
* chloridion (cl⁻): Kloratomer kan få et elektron til dannelse af en negativt ladet ion kaldet en chloridion. Dette er en meget almindelig form for klor, der findes i mange forbindelser og opløsninger.
Nøgleforskelle mellem kloratomer og chloridioner:
* opladning: Kloratomer er neutrale, mens chloridioner har en negativ ladning (-1).
* reaktivitet: Kloratomer er meget reaktive og danner let bindinger med andre elementer. Chloridioner er mindre reaktive og fungerer ofte som tilskuerioner i kemiske reaktioner.
* Elektronkonfiguration: Chloratomer har 7 valenselektroner, mens chloridioner har en komplet oktet af 8 valenselektroner.
Andre former:
* klorgas (CL₂): Dette er et diatomisk molekyle sammensat af to kloratomer bundet sammen. Det er en gulgrøn gas med en skarp lugt og er meget giftig.
* klorforbindelser: Klor danner adskillige forbindelser med andre elementer, såsom saltsyre (HCI), natriumchlorid (NaCI) og chlorofluorcarbons (CFC'er).
Kortfattet:
De forskellige former for kloratomer skyldes hovedsageligt tilstedeværelsen af isotoper og forstærkning eller tab af elektroner til dannelse af ioner. Isotoper har de samme kemiske egenskaber, men adskiller sig i masse, mens ioner har en anden ladning og reaktivitet sammenlignet med neutrale kloratomer.
 Varme artikler
Varme artikler
-
 Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø
Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skallerForskellige størrelser af det durian-afledte hydrogelplaster, hvor den kan gøres stor til operationssår eller klippes mindre til typisk bandagestørrelse. Kredit:Nanyang Technological University Fø -
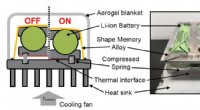 Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni
Termiske høreværn beskytter mobiltelefonens batterier mod ekstreme temperaturerDer vises en skematisk og foto af en termisk regulator designet af Berkeley-ingeniører til passivt at holde lithium-ion-batterier inden for et optimalt temperaturområde. Ved højere temperaturer, ledni -
 Forskning søger at fremme flyturbinens modstandsdygtighed over for partiklerEn US Marine MV-22B Osprey lander i Babadag Training Area, Rumænien, i denne fotoillustration fra 2015, og sparker skyer af potentielt farlige partikler op i processen. Forskning hos NPS, der anvender
Forskning søger at fremme flyturbinens modstandsdygtighed over for partiklerEn US Marine MV-22B Osprey lander i Babadag Training Area, Rumænien, i denne fotoillustration fra 2015, og sparker skyer af potentielt farlige partikler op i processen. Forskning hos NPS, der anvender -
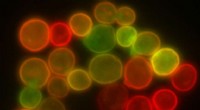 Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti
Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti
- Hvad gør et ekstremt miljø?
- Bevis på excitoniske isolatorer i moiré-supergitter
- NASA-NOAA-satellitten ser landfaldende orkanen Firenze
- Ny mikrostråleudsender har potentiale til at bringe lovende form for strålebehandling i klinisk br…
- Når du blander blå og gul, hvad laver det?
- Hvor kan man finde neutroner i et atom?


