Vil natriumchlorid opløses i diethylether?
* Polaritet: Natriumchlorid er en meget polær ionisk forbindelse. Den stærke elektrostatiske attraktion mellem de positivt ladede natriumioner (Na+) og de negativt ladede chloridioner (Cl-) gør det meget vanskeligt at bryde fra hinanden i et ikke-polært opløsningsmiddel.
* diethylether: Diethylether (CH3CH2OCH2CH3) er et ikke-polært opløsningsmiddel. Det har en lav dielektrisk konstant, hvilket betyder, at den ikke effektivt kan adskille og solvere de ladede ioner af natriumchlorid.
Kort sagt: "Som opløser som". Polære opløsningsmidler opløser polære opløste stoffer, og ikke-polære opløsningsmidler opløser ikke-polære opløste stoffer. Da natriumchlorid er polært og diethylether er ikke-polær, er de ikke kompatible til opløsning.
Sidste artikelHvad er egenskaberne ved carbonhydrid?
Næste artikelEr bestemt ikke en empirisk formel C12H16O3 C6H12O4 C12H22O11 C3H8O2?
 Varme artikler
Varme artikler
-
 Database for steganalyse af retsmedicinsk bevisJennifer Newman (nederst til højre) leder indsatsen for at opbygge en fotodatabase til steganalyseforskning. Kredit:Christopher Gannon Der er intet påfaldende eller bemærkelsesværdigt ved de titus
Database for steganalyse af retsmedicinsk bevisJennifer Newman (nederst til højre) leder indsatsen for at opbygge en fotodatabase til steganalyseforskning. Kredit:Christopher Gannon Der er intet påfaldende eller bemærkelsesværdigt ved de titus -
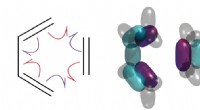 Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt
Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt -
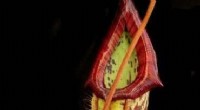 SLIPS og faldgruber:Syntetiske overflader inspireret af en kandefældefældeDen kødædende Nepenthes-fælde. Kredit:Oxford Science Blog Vores forståelse af, hvordan man manipulerer og kontrollerer væsker i teknologi, er blevet transformeret af de funktionelle overflader, de
SLIPS og faldgruber:Syntetiske overflader inspireret af en kandefældefældeDen kødædende Nepenthes-fælde. Kredit:Oxford Science Blog Vores forståelse af, hvordan man manipulerer og kontrollerer væsker i teknologi, er blevet transformeret af de funktionelle overflader, de -
 En stabil kobberkatalysator til omdannelse af kuldioxidKredit:CC0 Public Domain En ny katalysator til omdannelse af kuldioxid (CO 2 ) til kemikalier eller brændstoffer er blevet udviklet af forskere ved Ruhr-Universität Bochum og University of Duisb
En stabil kobberkatalysator til omdannelse af kuldioxidKredit:CC0 Public Domain En ny katalysator til omdannelse af kuldioxid (CO 2 ) til kemikalier eller brændstoffer er blevet udviklet af forskere ved Ruhr-Universität Bochum og University of Duisb
- Hvilket udtryk bruges til at beskrive en chipmunk, der spiser frø eller frugt?
- Hvad bremser en elektrisk strøm?
- Væske til gas varm eller kold?
- Kunne Schrödingers kat eksistere i det virkelige liv? Vores forskning kan snart give svaret
- Hvad bliver nedbør, der perkolerer i jorden?
- Hvordan sorte huller former galakser


