Lewis -strukturen for en bariumba ion ser ud som denne BA2, hvad der bedst beskriver sker, når atom danner en ion?
* Bariums elektronkonfiguration: Barium er i gruppe 2 i den periodiske tabel, hvilket betyder, at den har to valenselektroner (elektroner i dets yderste skal). Dens elektronkonfiguration er [XE] 6S².
* taber elektroner: For at opnå en stabil octet (otte elektroner i sin yderste skal) mister Barium let sine to valenselektroner. Dette resulterer i en positivt ladet ion med en +2 ladning.
* Lewis -struktur: Lewis -strukturen for Ba²⁺ repræsenterer simpelthen bariumatomet med en +2 ladning, hvilket indikerer tabet af to elektroner. Der er ingen prikker omkring symbolet, fordi det ikke har nogen valenselektroner tilbage.
Kortfattet: Når et bariumatom danner en ion, mister det to elektroner At blive en kation med en +2 opladning. Denne proces er drevet af ønsket om at opnå en stabil elektronkonfiguration.
Sidste artikelOrdligning for ammoniak og vand?
Næste artikelHvor mange elektroner er til stede i et neutralt bariumatom?
 Varme artikler
Varme artikler
-
 Smarte materialer, der bruges i ultralyd, opfører sig som vand, kemikere rapportererKredit:George Hodan/public domain Et team af forskere ved University of Pennsylvania får ny indsigt i de smarte materialer, der bruges i ultralydsteknologi. Mens de danner den mest grundige model
Smarte materialer, der bruges i ultralyd, opfører sig som vand, kemikere rapportererKredit:George Hodan/public domain Et team af forskere ved University of Pennsylvania får ny indsigt i de smarte materialer, der bruges i ultralydsteknologi. Mens de danner den mest grundige model -
 Forskere udvikler ny metode til at analysere metalHærens forskere Dr. Stephen Berkebile (til venstre) og Nikhil Murthy (til højre) undersøger, hvordan siliciumnitrid reagerer på stål under tør glidende mekanisk kontakt for bedre at forstå udstyrsnedb
Forskere udvikler ny metode til at analysere metalHærens forskere Dr. Stephen Berkebile (til venstre) og Nikhil Murthy (til højre) undersøger, hvordan siliciumnitrid reagerer på stål under tør glidende mekanisk kontakt for bedre at forstå udstyrsnedb -
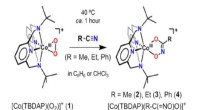 Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera
Nyt kompleks, der reagerer med nitril - en nøgle til at muliggøre nedregulering af kræftenzymerSyntetisk procedure for hydroximatocobaltkomplekser gennem reaktioner af et peroxocobaltkompleks 1 med nitriler. Kredit:DGIST Der er forskellige metalenzymer i menneskekroppen. Metalenzymer intera -
 Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
- Fra gær lærer forskere, hvordan befolkninger kollapser
- Klipper er klipper, der har ændret sig fra en type rock til en anden?
- Hvilke mineraler findes i shampoo?
- Hvad er navnene på stjerner større end sol?
- Mængden af varmeenergi, der kræves for at hæve den temperatur, som en enhedsmateriale en grad e…
- Hvad er smeltende isterninger?


