Hvad gør, når disse mix CO2 og H2O?
1. Fysisk blanding:
* opløst CO2 i vand: CO2 er lidt opløselig i vand og danner en opløsning. Dette er den mest almindelige interaktion ved stuetemperatur og tryk. Den opløste CO2 kan gøre vandet lidt surt.
* Dannelse af kulsyre (H2CO3): I vand reagerer en lille del af opløste CO2 med vandmolekyler til dannelse af kulsyre. Dette er en svag syre, der yderligere kan adskille sig i bicarbonat (HCO3-) og carbonat (CO32-) ioner.
* Blanding af gasformigt CO2 og flydende vand: Hvis CO2 bobles gennem vand, eller hvis de blandes under tryk, opløses CO2 i vandet, danner en opløsning og øger surhedsgraden.
2. Kemiske reaktioner:
* Fotosyntese: I nærvær af sollys og chlorophyll bruger planter CO2 og vand til at producere glukose og ilt. Dette er den primære måde CO2 fjernes fra atmosfæren.
* Carbonation: Når CO2 opløses under tryk i vand, danner det kulsyre, hvilket giver vandet en "fizzy" eller "mousserende" kvalitet, som det ses i kulsyreholdige drikkevarer.
* Dannelse af carbonater og bicarbonater: Kulsyre reagerer med mineraler som calciumcarbonat (CACO3) til dannelse af bicarbonater (f.eks. Calciumbicarbonat, CA (HCO3) 2). Denne proces er vigtig i dannelsen af huler og karst landskaber.
betingelser, der påvirker interaktionen:
* tryk: Højere tryk øger opløseligheden af CO2 i vand.
* Temperatur: Højere temperatur mindsker opløseligheden af CO2 i vand.
* ph: PH -værdien i opløsningen påvirker ligevægten mellem opløst CO2, kulsyre, bicarbonat og carbonationer.
Sammenfattende kan interaktionen mellem CO2 og H2O være en simpel fysisk blanding eller en mere kompleks kemisk reaktion, afhængigt af de specifikke betingelser. Disse interaktioner spiller en afgørende rolle i forskellige naturlige processer og har betydelige konsekvenser for miljøet og klimaet.
 Varme artikler
Varme artikler
-
 En ny cermet, der kunne give en bedre varmeudveksling til solenergianlægEn nylig udvikling ville gøre elproduktion fra solens varme mere effektiv, ved at bruge keramiske metalplader til varmeoverførsel ved højere temperaturer og ved forhøjede tryk. Kredit:Purdue Universit
En ny cermet, der kunne give en bedre varmeudveksling til solenergianlægEn nylig udvikling ville gøre elproduktion fra solens varme mere effektiv, ved at bruge keramiske metalplader til varmeoverførsel ved højere temperaturer og ved forhøjede tryk. Kredit:Purdue Universit -
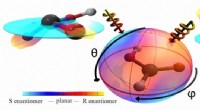 Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici
Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici -
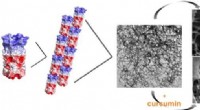 Forskere udvikler termo-responsiv proteinhydrogelEn illustration af, hvordan et konstrueret Q-protein selv samler sig for at danne fiberbaserede hydrogeler ved lav temperatur. Disse hydrogeler har en porøs mikrostruktur, der gør det muligt at bruge
Forskere udvikler termo-responsiv proteinhydrogelEn illustration af, hvordan et konstrueret Q-protein selv samler sig for at danne fiberbaserede hydrogeler ved lav temperatur. Disse hydrogeler har en porøs mikrostruktur, der gør det muligt at bruge -
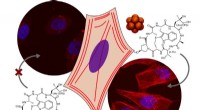 En ny måde at komme ind i cellen ved at bruge superkaotrope egenskaber for borklyngerSuperkaotropiske borklynger viste bæreraktivitet ikke kun i modelvesikler, men også i levende celler. Kredit:CiQUS Internalisering af uigennemtrængelige molekyler i celler er en aktuel udfordring i
En ny måde at komme ind i cellen ved at bruge superkaotrope egenskaber for borklyngerSuperkaotropiske borklynger viste bæreraktivitet ikke kun i modelvesikler, men også i levende celler. Kredit:CiQUS Internalisering af uigennemtrængelige molekyler i celler er en aktuel udfordring i


