Hvilken er forbindelsen med den mindste kulstofbinding?
* obligationslængde varierer: Obligationslængde afhænger af flere faktorer, herunder:
* de involverede atomer: En carbon-carbon enkeltbinding (C-C) er længere end en carbon-carbon-dobbeltbinding (C =C), som er længere end en carbon-carbon-tredobbelt binding (C≡C).
* Hybridisering: Hybridiseringen af carbonatomerne påvirker bindingslængden. For eksempel har SP3 -hybridiserede kulhydrater længere bindinger end SP2 -hybridiserede kulhydrater.
* de omgivende atomer og grupper: Elektrontrækkende grupper kan forkorte obligationer, mens elektron -donationsgrupper kan forlænge dem.
* specifikke forbindelser nødvendige: For at sammenligne skal vi kende de specifikke forbindelser, du spørger om.
Eksempel:
* ethan (C2H6) Har en enkelt C-C-obligation.
* ethylen (C2H4) har en dobbelt C =C -binding.
* acetylen (C2H2) Har en tredobbelt C≡C -binding.
C≡C-bindingen i acetylen er den korteste, efterfulgt af C =C-bindingen i ethylen og derefter C-C-bindingen i ethan.
For at få et mere specifikt svar skal du give de forbindelser, du vil sammenligne.
 Varme artikler
Varme artikler
-
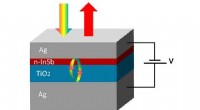 Forskere kommer på forbrugernes bølgelængde med InSb-teknologiSkematisk struktur af en elektrisk indstillelig perfekt lysabsorber. Teknologien til styring af lysabsorption ved udvalgte bølgelængder i nanostrukturer har fået stor opmærksomhed i de senere år;
Forskere kommer på forbrugernes bølgelængde med InSb-teknologiSkematisk struktur af en elektrisk indstillelig perfekt lysabsorber. Teknologien til styring af lysabsorption ved udvalgte bølgelængder i nanostrukturer har fået stor opmærksomhed i de senere år; -
 Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de
Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de -
 Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner meget reaktive forskydningsbånd af uordnet materiale, når de stødes til detonationsforhold, peger på en tidligere ikke registreret tændkilde
Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner meget reaktive forskydningsbånd af uordnet materiale, når de stødes til detonationsforhold, peger på en tidligere ikke registreret tændkilde -
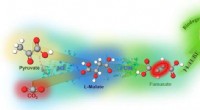 Lektioner fra naturlig fotosyntese til omdannelse af CO2 til råmaterialer til plastFumarat syntetiseres ved at binde CO2 til pyruvat med multi-biokatalysatorer. Malatdehydrogenase (ME) kombinerer pyruvat og kuldioxid (CO2) til L-malat, som kan omdannes til fumarat af fumarase (FUM).
Lektioner fra naturlig fotosyntese til omdannelse af CO2 til råmaterialer til plastFumarat syntetiseres ved at binde CO2 til pyruvat med multi-biokatalysatorer. Malatdehydrogenase (ME) kombinerer pyruvat og kuldioxid (CO2) til L-malat, som kan omdannes til fumarat af fumarase (FUM).
- Hvordan adskiller jord sig fra et sted til et andet?
- Kan migration, arbejdsstyrkens deltagelse og uddannelse balancerer omkostningerne ved aldring i Euro…
- Hvilket af følgende er et karakteristisk massivt sølv?
- Astronomer afslører interstellar tråd af en af livets byggesten
- En videnskabelig lov En forklaring af ting eller begivenheder baseret på observationer forklaringer…
- Hvornår fremstiller blade og grønne stængler af planter mad?


