Hvor mange valenselektroner er der i et fluoratom, at atomer danner bindinger?
* valenselektroner i fluor: Fluor har 7 valenselektroner .
* Hvorfor atomer danner obligationer: Atomer danner bindinger for at opnå en stabil elektronkonfiguration, der ideelt ligner elektronkonfigurationen af en ædelgas. Noble gasser er meget ureaktive, fordi de har en fuld ydre skal af elektroner, hvilket gør dem meget stabile.
* fluorens bindingsadfærd: Fluor, med 7 valenselektroner, er kun en elektron væk fra at have en fuld ydre skal (som neon, der har 8). Derfor har fluor en tendens til at få et elektron for at afslutte sin ydre skal. Derfor er det meget reaktivt og danner obligationer let.
* Typer af obligationer: Fluor danner typisk ioniske bindinger med metaller, hvor det får et elektron fra metalatomet. Det danner også kovalente bindinger med ikke -metaller, hvor det deler elektroner for at opnå en fuld ydre skal.
Kortfattet: Fluorens høje reaktivitet er drevet af dets behov for at få et elektron for at opnå en stabil oktetkonfiguration. Dette fører til dannelse af bindinger med andre atomer.
 Varme artikler
Varme artikler
-
 Forskere indser homogenisering af overfladeaktive steder af heterogen katalysatorKredit:Unsplash/CC0 Public Domain For nylig, et team ledet af professor Wu Changzheng fra School of Chemistry and Materials Science fra University of Science and Technology of China (USTC) i samar
Forskere indser homogenisering af overfladeaktive steder af heterogen katalysatorKredit:Unsplash/CC0 Public Domain For nylig, et team ledet af professor Wu Changzheng fra School of Chemistry and Materials Science fra University of Science and Technology of China (USTC) i samar -
 Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange
Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange -
 Forskere klemmer katalysatorer inde i værtsmaterialer som et skib i en flaskeVed hjælp af termodynamiske Pourbaix-diagrammer, videnskabsmænd kan presse katalysatorer inde i værtsmaterialer som et skib i en flaske. Kredit:Jingwei Hou Forskere ved Queen Mary University of Lo
Forskere klemmer katalysatorer inde i værtsmaterialer som et skib i en flaskeVed hjælp af termodynamiske Pourbaix-diagrammer, videnskabsmænd kan presse katalysatorer inde i værtsmaterialer som et skib i en flaske. Kredit:Jingwei Hou Forskere ved Queen Mary University of Lo -
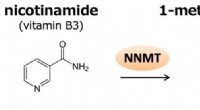 Søjlelignende molekyler som biosensorer for metabolitterNNMT katalyserer methyleringen af nikotinamid til fremstilling af 1-methylnicotinamid (1-MNA). 1-MNA kan yderligere oxideres af aldehydoxidase til, N1-methyl-2-pyridon-5-carboxamid (2py) eller N1-me
Søjlelignende molekyler som biosensorer for metabolitterNNMT katalyserer methyleringen af nikotinamid til fremstilling af 1-methylnicotinamid (1-MNA). 1-MNA kan yderligere oxideres af aldehydoxidase til, N1-methyl-2-pyridon-5-carboxamid (2py) eller N1-me
- Hvis et pund vand har en temperatur på 32 grader Fahrenheit, hvor mange BTU'er skal så fjernes for…
- Vandret løb kunne hjælpe måneastronauter med at bevare fysisk kondition
- Hvorfor jagt efter hurtige radioudbrud er et 'eksploderende felt' i astronomi
- Hvor er alle søålene blevet af? spørger Dronningens prof
- Hvad er brændstofkilden, der bruges til glycolyse?
- Hvilke dele af cellen er inkluderet i teorien?


