Hvad ville der dannes ved katoden og anoden under elektrolyse af natriumhydroxidopløsning?
Elektrolyse af natriumhydroxidopløsning
* elektrolyt: Vandlig opløsning af NaOH (natriumhydroxid). Denne opløsning indeholder Na+ -ioner, OH-ioner og vandmolekyler.
* Elektroder: Normalt bruges inerte elektroder som platin eller nikkel til at undgå uønskede reaktioner.
reaktioner på elektroderne
* katode (negativ elektrode):
* Primær reaktion: Vandmolekyler får elektroner og reduceres til brintgas og hydroxidioner:
2H₂O + 2E⁻ → H₂ (G) + 2OH⁻
* Årsag: Hydrogenioner (H+) er meget mindre rigelige i en grundlæggende opløsning, hvilket gør reduktionen af vand mere gunstig.
* anode (positiv elektrode):
* Primær reaktion: Hydroxidioner mister elektroner og oxideres til iltgas og vand:
4OH⁻ → O₂ (G) + 2H₂O + 4E⁻
* Årsag: Oxidationen af hydroxidioner er mere gunstig end oxidation af vand.
Sammendrag af produkter
* katode: Brintgas (H₂) produceres.
* anode: Oxygengas (O₂) produceres.
Vigtig note: Koncentrationen af NaOH kan stige lidt ved katoden på grund af dannelsen af yderligere hydroxidioner. Imidlertid forbliver den samlede sammensætning af opløsningen stort set den samme.
Lad mig vide, om du gerne vil have en mere detaljeret forklaring af de elektrokemiske principper bag denne proces!
 Varme artikler
Varme artikler
-
 Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert
Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert -
 Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel
Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel -
 Langrødt fluorescerende silke kan dræbe skadelige bakterier som biomedicinsk og miljømæssigt mid…Når et grønt lys skinner på rød fluorescerende silke, en mekanisme til at dræbe patogener aktiveres. Kredit:Purdue University image/Jung Woo Leem Et silkehybridmateriale angriber bakterier, når de
Langrødt fluorescerende silke kan dræbe skadelige bakterier som biomedicinsk og miljømæssigt mid…Når et grønt lys skinner på rød fluorescerende silke, en mekanisme til at dræbe patogener aktiveres. Kredit:Purdue University image/Jung Woo Leem Et silkehybridmateriale angriber bakterier, når de -
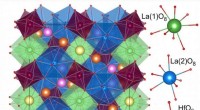 Forskere syntetiserer et nyt fosforKrystallstruktur af forbindelsen. Kredit:Yana Baklanova (medforfatter af undersøgelsen) Kemikere og fysikere fra Ural Federal University og Institute of Chemistry of Faststoffer fra Ural Branch of
Forskere syntetiserer et nyt fosforKrystallstruktur af forbindelsen. Kredit:Yana Baklanova (medforfatter af undersøgelsen) Kemikere og fysikere fra Ural Federal University og Institute of Chemistry of Faststoffer fra Ural Branch of
- Jordskælv forårsaget af industrielle aktiviteter - hvad er risiciene, og hvordan kan de reduceres?
- Hvordan ændrede udviklingen af planter atmosfære?
- Kan jordskælvsrater på størrelsesorden 4 bruges til at forudsige store begivenheder?
- Hvad er elementerne i forbindelser?
- Kunne du liste måderne at se Grand Canyon på?
- Hvilken funktion er unik for jorden?


