Hvilken masse fluorgas er nødvendig for at reagere fuldstændigt med 17,8 g svovlform hexafluorid?
1. Skriv den afbalancerede kemiske ligning:
S (S) + 3F₂ (G) → SF₆ (G)
2. Konverter gram svovl til mol:
* Molær masse svovl (r) =32,06 g/mol
* Mol s =(17,8 g) / (32,06 g / mol) =0,555 mol
3. Brug molforholdet fra den afbalancerede ligning for at finde mol fluor:
* Fra ligningen reagerer 1 mol svovl med 3 mol fluor.
* Mol F₂ =(0,555 mol s) * (3 mol f₂ / 1 mol s) =1,665 mol f₂
4. Konverter mol fluor til gram:
* Molær masse fluor (f₂) =38,00 g/mol
* Masse af f₂ =(1,665 mol f₂) * (38,00 g/mol) = 63,27 g
Derfor er 63,27 g fluorgas nødvendig for at reagere fuldstændigt med 17,8 g svovl for at danne svovl hexafluorid.
Sidste artikelNavngiv de to ioner, der findes i natriumchlorid?
Næste artikelHvad er en homogen blanding?
 Varme artikler
Varme artikler
-
 Gør det muligt at oprette større 3D-trykte objekter med keramikSteyn Westbeek. Kredit:Eindhoven University of Technology Keramik er nogle af de ældste materialer fremstillet af mennesker. På samme tid, de er nogle af de mest lovende materialer til nøgleteknol
Gør det muligt at oprette større 3D-trykte objekter med keramikSteyn Westbeek. Kredit:Eindhoven University of Technology Keramik er nogle af de ældste materialer fremstillet af mennesker. På samme tid, de er nogle af de mest lovende materialer til nøgleteknol -
 Små ændringer i overfladeaktive strukturer påvirker dets evne til at indkapsle olieagtige molekyl…Et overfladeaktivt stof (vist med rødt, gul og turkis) med en 14-carbon ‘hale’ danner et bølgende lag mellem vand (farveløst) og decan (grønt), som udvikler sig til knopper (midten) og derefter frie m
Små ændringer i overfladeaktive strukturer påvirker dets evne til at indkapsle olieagtige molekyl…Et overfladeaktivt stof (vist med rødt, gul og turkis) med en 14-carbon ‘hale’ danner et bølgende lag mellem vand (farveløst) og decan (grønt), som udvikler sig til knopper (midten) og derefter frie m -
 Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm
Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm -
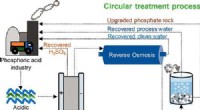 Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
- En ny måde at teste kropspanser på
- Hvilken proces opvarmer stoffet på jorden?
- Hvilken masse af kaliumbenzoattrihydrat er nødvendig for at fremstille en liter en 0,125 molær opl…
- Forståelse af bakteriemotorer kan føre til mere effektive nanomaskiner
- Hvilken planet har en måne mere end halvdelen af sin størrelse?
- Billede:En verden af sneklædte klitter på Mars


