Klor og kaliumiodidbalanceret ligning?
cl₂ (g) + 2 ki (aq) → 2 kCl (aq) + i₂ (s)
Her er hvad der sker i reaktionen:
* klor (cl₂) er et stærkt oxidationsmiddel: Den ønsker at få elektroner og blive negativt ladet.
* iodidioner (I-) i kaliumiodid (KI) oxideres let: De mister let elektroner.
I reaktionen:
* Chlor (CL₂) fortrænger jod (i₂) fra kaliumiodid (KI).
* Chlor (CL₂) får elektroner og danner chloridioner (Cl-), der kombineres med kaliumioner (K+) for at danne kaliumchlorid (KCL).
* Jod (i₂) oxideres og danner fast jod (i₂).
Denne reaktion er et klassisk eksempel på en enkelt forskydningsreaktion hvor en mere reaktiv halogen (klor) fortrænger en mindre reaktiv halogen (jod) fra dens forbindelse.
Sidste artikelHvordan skriver du 3 brint og 1 nitrogen?
Næste artikelHvad er valensladningen for iod KiO2?
 Varme artikler
Varme artikler
-
 Hemmeligheden bag vedvarende solbrændstoffer er et off-and-on igen forholdEt nærbillede af et stykke kobbermalm. Kredit:Coldmoon Photoproject/Shutterstock De siger, at det er bedre at have haft noget særligt og mistet det end aldrig at have haft det overhovedet. Hvem vi
Hemmeligheden bag vedvarende solbrændstoffer er et off-and-on igen forholdEt nærbillede af et stykke kobbermalm. Kredit:Coldmoon Photoproject/Shutterstock De siger, at det er bedre at have haft noget særligt og mistet det end aldrig at have haft det overhovedet. Hvem vi -
 Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker
Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker -
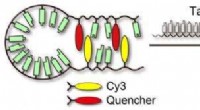 Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru
Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru -
 Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de
Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de
- Hvilken energikilde bruger brændselscelle?
- Grønning på høje breddegrader kan hæmme udvidelsen af mellembredde-ørkener
- Kæmpe lasere krystalliserer vand med chokbølger, afslører atomstrukturen af superionisk is
- Hvad er ordligningen, når magnesiumoxid dannes af metal og iltgas?
- Er ægceller i aldrende primater beskyttet mod mutationer?
- Hvorfor er det vigtigt for forskere at være objektiv?


