Hvorfor danner BCL3 ikke en dobbeltbinding med et chloratom og enkelt andre to atomer?
1.. Borons elektronkonfiguration: Bor har kun tre valenselektroner. For at danne en dobbeltbinding ville den have brug for fire elektroner i sin ydre skal. Dette er ikke muligt med bores elektroniske struktur.
2. octet regel: Bor i BCL3 har kun seks elektroner omkring det, hvilket er mindre end octetreglen kræver for stabilitet. En dobbeltbinding ville give bor 10 elektroner, der overskrider oktetreglen.
3. Backbonding: Mens bor kan teoretisk danne en dobbeltbinding, er det ikke energisk gunstigt. Den dobbelte binding involverer en bagdonation af elektrondensitet fra et klorelone par til boren tomme p orbital. Denne ryggen er svag og bidrager ikke væsentligt til stabiliteten af molekylet.
4. bindingslængder og vinkler: De observerede bindingslængder og vinkler i BCL3 er i overensstemmelse med enkeltbindinger. B-CL-bindingslængden er længere end forventet for en dobbeltbinding, og bindingsvinklerne er tæt på 120 grader, hvilket indikerer en trigonal plan geometri.
5. Eksperimentelt bevis: BCL3 er en kendt stabil forbindelse, og dens egenskaber er i overensstemmelse med en trigonal plan geometri med tre enkeltbindinger. Intet bevis understøtter eksistensen af en dobbeltobligation.
I resuméet danner BCL3 ikke en dobbeltbinding på grund af bores begrænsede valenselektroner, oktetreglen, svagheden ved ryggen og de eksperimentelle beviser, der understøtter enkeltbindinger.
 Varme artikler
Varme artikler
-
 Digital penicillinproduktionBioreaktor ved TU Wien. Kredit:Vienna University of Technology TU Wien og Sandoz GmbH har med succes implementeret en computersimulering i realtid af penicillinproducerende organismers komplekse v
Digital penicillinproduktionBioreaktor ved TU Wien. Kredit:Vienna University of Technology TU Wien og Sandoz GmbH har med succes implementeret en computersimulering i realtid af penicillinproducerende organismers komplekse v -
 Forskere udvikler ikke-ædellegeringskatalysator til kanelaldehyd(en). Skematisk illustration af synteseproceduren for FeXCo@NC; (b). TEM-billede (indsæt:TEM-billede med høj forstørrelse og Fe-Co NPs størrelsesfordeling); (c) XRD-mønster; (d-e) HAADF-STEM, tilsvare
Forskere udvikler ikke-ædellegeringskatalysator til kanelaldehyd(en). Skematisk illustration af synteseproceduren for FeXCo@NC; (b). TEM-billede (indsæt:TEM-billede med høj forstørrelse og Fe-Co NPs størrelsesfordeling); (c) XRD-mønster; (d-e) HAADF-STEM, tilsvare -
 Nanoteknologi gør det muligt for ingeniører at svejse tidligere usvejsbare aluminiumslegeringerTo stykker aluminiumslegering 7075 svejset sammen ved hjælp af en nanopartikel-forstærket fyldtråd. Kredit:Oszie Tarula/UCLA En aluminiumslegering udviklet i 1940erne har længe holdt et løfte til
Nanoteknologi gør det muligt for ingeniører at svejse tidligere usvejsbare aluminiumslegeringerTo stykker aluminiumslegering 7075 svejset sammen ved hjælp af en nanopartikel-forstærket fyldtråd. Kredit:Oszie Tarula/UCLA En aluminiumslegering udviklet i 1940erne har længe holdt et løfte til -
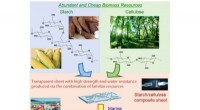 Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
- Hvor mange gange er jordens diameter dens afstand fra solen?
- Hvordan dannes en oceanisk oser?
- Hvilke bindinger er karakteriseret mest til mindst ioniske?
- Sådan konverteres tommer til en fraktion
- Hvordan konserveres energi, når en cykel stopper?
- Varigheden af Amazon France-lukningen ukendt, siger chefen


