Hvorfor er svovldioxidpolar og kulstof ikke, når begge har kovalent binding?
Her er en sammenbrud:
svovldioxid (SO₂):
* Geometri: Bøjet (eller V-formet)
* Polaritet: Polær
* Forklaring: Svovlatomet har to iltatomer fastgjort til det, og de ensomme par på svovlatomet skaber en forvrænget geometri. Denne ujævne fordeling af elektrondensitet resulterer i et dipolmoment, hvilket gør molekylet polært.
kuldioxid (CO₂):
* Geometri: Lineær
* Polaritet: Ikke -polær
* Forklaring: Carbonatomet er bundet til to iltatomer med en lineær geometri. Elektronegativitetsforskellen mellem kulstof og ilt skaber polære bindinger i molekylet. Imidlertid er de to polære bindinger lige og modsatte og annullerer effektivt hinanden. Dette resulterer i et ikke -polært molekyle.
Nøgle takeaways:
* molekylær geometri: Formen på molekylet spiller en afgørende rolle i bestemmelsen af polaritet.
* Elektronegativitetsforskel: Forskellen i elektronegativitet mellem atomer bestemmer polariteten af individuelle bindinger.
* annullering af dipoler: I symmetriske molekyler, selvom individuelle bindinger er polære, kan det samlede molekyle være ikke -polært på grund af annullering af dipoler.
Fortæl mig, hvis du har andre spørgsmål om polaritet og kemisk binding!
 Varme artikler
Varme artikler
-
 Tredobling af effektiviteten af solbaseret brintbrændstofproduktion med metalliske nanostrukturer…Et nanostruktureret metamateriale med et solsikke-lignende arrangement kan nedsænkes i vand for at generere hydrogengas med en suveræn effektivitet. Kredit:WILEY-VCH Verlag GmbH &Co. Hydrogengas,
Tredobling af effektiviteten af solbaseret brintbrændstofproduktion med metalliske nanostrukturer…Et nanostruktureret metamateriale med et solsikke-lignende arrangement kan nedsænkes i vand for at generere hydrogengas med en suveræn effektivitet. Kredit:WILEY-VCH Verlag GmbH &Co. Hydrogengas, -
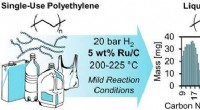 En mild måde at opgradere plastik brugt i flasker til brændstof og andre højværdiprodukterKredit:American Chemical Society Plast er allestedsnærværende i menneskers liv. Endnu, når plastholdige genstande har opfyldt deres missioner, kun en lille mængde genanvendes til nye produkter, so
En mild måde at opgradere plastik brugt i flasker til brændstof og andre højværdiprodukterKredit:American Chemical Society Plast er allestedsnærværende i menneskers liv. Endnu, når plastholdige genstande har opfyldt deres missioner, kun en lille mængde genanvendes til nye produkter, so -
 Ny forskning i risikoen for blyeksponering fra kugler brugt til storvildtsjagtAdam Leontowich holder blok af ballistisk gelatine ved BMIT-strålelinjen ved CLS. Kredit:Canadian Light Source Blyet i nogle kugler, der bruges til jagt på hjorte, elge og elge, er giftigt for de m
Ny forskning i risikoen for blyeksponering fra kugler brugt til storvildtsjagtAdam Leontowich holder blok af ballistisk gelatine ved BMIT-strålelinjen ved CLS. Kredit:Canadian Light Source Blyet i nogle kugler, der bruges til jagt på hjorte, elge og elge, er giftigt for de m -
 Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v
Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v
- Iskolde skyer kunne have holdt den tidlige Mars varm nok til floder og søer, undersøgelse finder
- Unge menneskers tillid til regeringen er skadet på lang sigt af COVID-19
- Fordele og ulemper ved optiske teleskoper
- I hvilken form rejser Radiant Energy?
- Hvad er overførslen af varmeenergi inden for et objekt?
- Tilsluttet parallelt hvilken pære vil gløde lysere en 40 watt eller en 100 pære?


