Tendens til at vise -2 oxidationstilstand falder fra svovlpolonium i gruppe 16 hvorfor?
* stigende atomstørrelse: Når du bevæger dig ned ad gruppen, øges atomradius. Dette betyder, at de yderste elektroner er længere væk fra kernen og oplever svagere tiltrækning.
* Faldende ioniseringsenergi: Følgelig falder ioniseringsenergien (energi, der kræves for at fjerne en elektron), ned i gruppen. Det bliver lettere at fjerne elektroner fra tungere elementer.
* Faldende elektronegativitet: Elektronegativitet, et atoms evne til at tiltrække elektroner, falder også ned i gruppen. Dette betyder, at de tungere elementer er mindre tilbøjelige til at få to elektroner for at opnå en -2 oxidationstilstand.
Hvorfor er -2 oxidationstilstand vigtig?
-2 -oxidationstilstand repræsenterer dannelsen af en anion ved at vinde to elektroner og opnå en stabil octet -konfiguration.
Tendensen i gruppe 16:
* ilt (O): Meget elektronegativ, får let to elektroner til dannelse af oxidion (O²⁻). Det viser -2 oxidationstilstand næsten udelukkende.
* svovl (r): Svovl kan udvise -2 oxidationstilstand i mange forbindelser, men viser også andre oxidationstilstande som +2, +4 og +6 på grund af dens større størrelse og lavere elektronegativitet.
* selen (SE) og tellurium (TE): Disse elementer er mindre tilbøjelige til at opnå -2 oxidationstilstand lige så let som ilt og svovl. De kan deltage i binding med forskellige oxidationstilstande, herunder positive.
* polonium (PO): Det mest metalliske element i gruppen er det mere sandsynligt, at polonium udviser positive oxidationstilstande end -2.
Kortfattet: Den faldende elektronegativitet og stigende atomstørrelse ned i gruppe 16 gør det mindre gunstigt for tungere elementer at få to elektroner og opnå en -2 oxidationstilstand.
Sidste artikelHvad er formelenheden til natriumphosphid?
Næste artikelHvad er de ikke -metaller i halogener?
 Varme artikler
Varme artikler
-
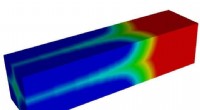 Undersøgelse afslører ukendte detaljer om almindelige lithium-ion batterimaterialerEn illustration viser væksten af en lithium-mangel fase (blå) på bekostning af en lithium-rig fase (rød) i en lithium jernfosfat mikrostav. Rice University-forskere ledede en undersøgelse, der fandt
Undersøgelse afslører ukendte detaljer om almindelige lithium-ion batterimaterialerEn illustration viser væksten af en lithium-mangel fase (blå) på bekostning af en lithium-rig fase (rød) i en lithium jernfosfat mikrostav. Rice University-forskere ledede en undersøgelse, der fandt -
 En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te
En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te -
 Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi
Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi -
 Kina udvikler verdens første instrumentsystem til Raman-aktiveret cellesortering og sekventeringKredit:CC0 Public Domain Verdens første instrumentsystem til Raman-aktiveret cellesortering og sekventering (RACS-SEQ) blev for nylig udviklet i det østlige Kinas Qingdao City, muliggøre funktione
Kina udvikler verdens første instrumentsystem til Raman-aktiveret cellesortering og sekventeringKredit:CC0 Public Domain Verdens første instrumentsystem til Raman-aktiveret cellesortering og sekventering (RACS-SEQ) blev for nylig udviklet i det østlige Kinas Qingdao City, muliggøre funktione
- Sjældent glasagtigt metal opdaget under søgen efter at forbedre batteriets ydeevne
- Hvilken meget stor organisk forbindelse består af kæder mindre molekyler?
- Hvorfor har raketter potentiel energi?
- Har kystsletterne frugtbar jord?
- Ny undersøgelse viser, hvad den interstellare besøgende 'Oumuamua kan lære os
- Tæt netværk af seismometre afslører, hvordan undergrunden brister


