Hvad indeholder koordinat kovalente bindinger HCL HFL H20 eller H30 1?
Koordiner kovalente obligationer
* En koordinat kovalent binding (også kaldet en dativbinding) opstår, når et atom bidrager begge elektroner til det delte par i en binding.
* Elektronparret doneres fra et ensomt par på det ene atom til en tom orbital på det andet atom.
Analyse af molekylerne:
* HCL (hydrogenchlorid): Dette er en normal kovalent binding, hvor hvert atom bidrager med en elektron.
* HF (hydrogenfluorid): Dette er også en normal kovalent binding.
* h₂o (vand): Vand indeholder normale kovalente bindinger mellem ilt- og brintatomer. Det er dog vigtigt at forstå, at iltatomet i vand har to ensomme par elektroner. Dette gør vand til en god elektrondonor til dannelse af koordinat kovalente bindinger.
* h₃o⁺ (hydroniumion): Det er her vi finder den koordinat kovalente binding!
* dannelse: H₃O⁺ dannes, når et vandmolekyle (H₂O) accepterer en proton (H⁺) fra en syre.
* binding: Protonen (H⁺) har en tom orbital. Et af de ensomme par på iltatomet i vand udgør en koordinat kovalent binding med denne tomme orbital.
Konklusion:
* H₃O⁺ (hydroniumion) indeholder en koordinat kovalent binding.
Fortæl mig, hvis du gerne vil have mere forklaring på nogen af disse molekyler!
Sidste artikelHvad er 2 eksempler på fast vand?
Næste artikelFormlen for forbindelsen dannet, når aluminium og klorbinding?
 Varme artikler
Varme artikler
-
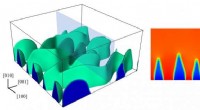 Ikke så hurtigt:Nogle batterier kan skubbes for langtTil venstre, en 3D-model af Rice Universitys materialeforskere viser en fasegrænse, da en delithierende lithiumjernphosphatkatode undergår hurtig afladning. Til højre, et tværsnit viser den fingerlign
Ikke så hurtigt:Nogle batterier kan skubbes for langtTil venstre, en 3D-model af Rice Universitys materialeforskere viser en fasegrænse, da en delithierende lithiumjernphosphatkatode undergår hurtig afladning. Til højre, et tværsnit viser den fingerlign -
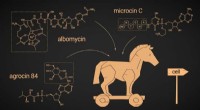 Pas på andre bakterier, der bærer gaver:Forskning præsenterer nye potentielle antimikrobielle mid…Trojansk hest-strategi Kredit:Pavel Odinev/Skoltech Skoltech -forskere undersøgte de antibiotiske forbindelser, der anvender en trojansk hest -strategi for at komme ind i en bakteriecelle uigenken
Pas på andre bakterier, der bærer gaver:Forskning præsenterer nye potentielle antimikrobielle mid…Trojansk hest-strategi Kredit:Pavel Odinev/Skoltech Skoltech -forskere undersøgte de antibiotiske forbindelser, der anvender en trojansk hest -strategi for at komme ind i en bakteriecelle uigenken -
 Forskergruppe finder på at omdanne plastikaffaldsprodukter til jetbrændstofDr. Hanwu Lei og hans forskerhold i laboratoriet, arbejder på at finde en anvendelse til plastaffald. Kredit:Washington State University En forskergruppe ledet af videnskabsmænd fra Washington Sta
Forskergruppe finder på at omdanne plastikaffaldsprodukter til jetbrændstofDr. Hanwu Lei og hans forskerhold i laboratoriet, arbejder på at finde en anvendelse til plastaffald. Kredit:Washington State University En forskergruppe ledet af videnskabsmænd fra Washington Sta -
 Befri oceanerne for plastik ved at omdanne affaldet til værdifuldt brændstofJames Holm (billedet) og Swaminathan Ramesh, Ph.D., gik sammen om at udvikle en mobil reaktor (også på billedet) til at omdanne affaldsplastik til brændstof. Kredit:Claudia Rocha Milliarder af pou
Befri oceanerne for plastik ved at omdanne affaldet til værdifuldt brændstofJames Holm (billedet) og Swaminathan Ramesh, Ph.D., gik sammen om at udvikle en mobil reaktor (også på billedet) til at omdanne affaldsplastik til brændstof. Kredit:Claudia Rocha Milliarder af pou
- Typer af vejeskalaer og deres funktion
- Rimelig behandling af supermarkeder er nøglen til leverandørernes ydeevne
- Hvilken handling producerer et fald i både den elektriske kraft og gravitation mellem 2 ladede obje…
- At løse et gammelt mejerimysterium kan hjælpe med at helbrede moderne madsygdomme
- Hvor lang tid tager det for en metamorfe klippe at blive til stødende klippe?
- Hvad er 78,5c i Fahrenheit?


