Hvad er reaktionen, der finder sted, når kobber i sølvnitratopløsning?
reaktionen:
Kobber (Cu) er mere reaktiv end sølv (AG). Dette betyder, at kobber kan fortrænge sølv fra dets sammensætning. Kobberatomerne mister elektroner og bliver kobber (II) -ioner (Cu²⁺), mens sølvioner (AG⁺) får elektroner og bliver sølvatomer (Ag).
Den kemiske ligning:
`` `
Cu (s) + 2agno₃ (aq) → cu (no₃) ₂) (aq) + 2ag (s)
`` `
Hvad du observerer:
* sølvkrystaller: Du vil se skinnende, sølvfarvede krystaller, der dannes på kobberens overflade. Dette er de sølvatomer, der blev forskudt fra opløsningen.
* blå løsning: Opløsningen bliver blå som kobber (II) nitrat (Cu (No₃) ₂) former.
Forklaring:
1. kobberatomer mister elektroner: Kobberatomer oxideres, hvilket betyder, at de mister elektroner til dannelse af kobber (II) -ioner (Cu²⁺).
2. sølvioner får elektroner: Sølvioner (AG⁺) reduceres, hvilket betyder, at de får elektroner til dannelse af sølvatomer (AG).
3. forskydning: Jo mere reaktiv kobber fortrænger, jo mindre reaktivt sølv fra sølvnitratopløsningen.
nettoionisk ligning:
Den nettoioniske ligning fokuserer på de arter, der er direkte involveret i reaktionen:
`` `
Cu (S) + 2Ag⁺ (aq) → Cu²⁺ (aq) + 2ag (s)
`` `
Denne reaktion demonstrerer reaktivitetsserien af metaller, og hvordan et mere reaktivt metal kan fortrænge et mindre reaktivt metal fra dens forbindelse.
Sidste artikelHvor mange kovalente obligationer dannes bor?
Næste artikelHvad er den rigtige formel for bromidion?
 Varme artikler
Varme artikler
-
 Hvordan forskere opfinder nye farverSommerfuglvinger, ligesom monark sommerfuglens, har inspireret forskere til at skabe strukturelle farver. Kredit:te maeklong/Shutterstock I titusinder af år, mennesker har skabt farver gennem simp
Hvordan forskere opfinder nye farverSommerfuglvinger, ligesom monark sommerfuglens, har inspireret forskere til at skabe strukturelle farver. Kredit:te maeklong/Shutterstock I titusinder af år, mennesker har skabt farver gennem simp -
 Glaslignende træ isolerer varme, er hård, blokerer UV og har trækornet mønsterIngeniører ved University of Maryland designede et gennemsigtigt loft lavet af træ, der fremhæver det naturlige trækornmønster. Kredit:A.James Clark School of Engineering, University of Maryland B
Glaslignende træ isolerer varme, er hård, blokerer UV og har trækornet mønsterIngeniører ved University of Maryland designede et gennemsigtigt loft lavet af træ, der fremhæver det naturlige trækornmønster. Kredit:A.James Clark School of Engineering, University of Maryland B -
 Video:Hvorfor smider vi gødning på skovbrande?Kredit:The American Chemical Society Når skovbrande udbryder på varme, blæsende dage, de udgør en alvorlig trussel mod mennesker og miljø. Denne uge om reaktioner, Lær, hvordan brandmænd bruger g
Video:Hvorfor smider vi gødning på skovbrande?Kredit:The American Chemical Society Når skovbrande udbryder på varme, blæsende dage, de udgør en alvorlig trussel mod mennesker og miljø. Denne uge om reaktioner, Lær, hvordan brandmænd bruger g -
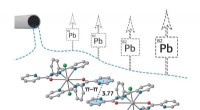 Kemikere foreslår nye reagenser til fjernelse af bly fra spildevandKredit:RUDN University RUDN -universitetets kemikere har sammen med kolleger fra andre lande syntetiseret nye forbindelser, der effektivt binder blyioner og kan bruges til at fjerne det fra spilde
Kemikere foreslår nye reagenser til fjernelse af bly fra spildevandKredit:RUDN University RUDN -universitetets kemikere har sammen med kolleger fra andre lande syntetiseret nye forbindelser, der effektivt binder blyioner og kan bruges til at fjerne det fra spilde
- Hvilket terrestrisk biom er kendetegnet ved varmt vejr i kraftig regn hvert år omkring?
- Røntgenfotoelektronspektroskopi af brint og helium
- Sådan får du det samlede antal værdier på en forbindelse
- Miniaturemagnetiske svømmeapparater til revolutionering af diagnostik og medicinlevering
- Super-Earth Ross 508b skimmer den beboelige zone af rød dværg
- Hvad er forskellen mellem absolut og relativ magt?


