Hvorfor danner benzoesyre en dimer i benzen og ikke vand?
i benzen:
* benzen er et ikke-polært opløsningsmiddel: Det kan ikke danne hydrogenbindinger med benzoesyre.
* Hydrogenbinding inden for benzoesyre: Benzoesyremolekyler kan danne stærke hydrogenbindinger mellem carboxylgruppen (COOH) af et molekyle og carbonylgruppen (C =O) for en anden. Denne intermolekylære hydrogenbinding fører til dannelse af dimerer.
* gunstige interaktioner: Dimerdannelsen i benzen foretrækkes, fordi den minimerer eksponeringen af den polære carboxylgruppe for det ikke-polære miljø, hvilket fører til en mere stabil konfiguration.
i vand:
* vand er et polært opløsningsmiddel: Vandmolekyler kan danne stærke brintbindinger med carboxylgruppen af benzoesyre.
* Konkurrence om hydrogenbinding: Den stærke hydrogenbinding mellem benzoesyre og vandmolekyler konkurrerer med hydrogenbindingen mellem benzoesyremolekyler, hvilket gør dimerdannelse mindre gunstig.
* gunstige interaktioner: Benzoesyremolekyler foretrækker at interagere med vandmolekyler gennem hydrogenbinding, hvilket er mere energisk gunstigt end dannelse af dimerer.
Sammendrag:
Forskellen i opløsningsmiddelpolaritet og evnen til at danne hydrogenbindinger fører til dannelse af benzoesyredimerer i benzen, men ikke i vand. Den ikke-polære karakter af benzen favoriserer dimerisering, mens den polære natur af vand fremmer hydrogenbinding mellem benzoesyre og vandmolekyler, hvilket forhindrer dannelse af dimer.
Sidste artikelHvad er formlen for propanon?
Næste artikelHvad er en cool ting ved svovl?
 Varme artikler
Varme artikler
-
 I betragtning af virkningen af den indendørs kemi -cocktailKredit:CC0 Public Domain Et par forskere, et med det kinesiske videnskabsakademi i Kina, den anden med University of Toronto i Canada har genbesøgt emnet indendørs kemi og dens indvirkning på menn
I betragtning af virkningen af den indendørs kemi -cocktailKredit:CC0 Public Domain Et par forskere, et med det kinesiske videnskabsakademi i Kina, den anden med University of Toronto i Canada har genbesøgt emnet indendørs kemi og dens indvirkning på menn -
 Forskere overvejer kompleksiteten ved bioprintning af flercellede vævSUTD leder en dybdegående gennemgang af den forestående virkelighed i 3D-trykte organer og analyserer de seneste resultater, begrænsninger og muligheder for fremtidig forskning. Kredit:SUTD 3D-bio
Forskere overvejer kompleksiteten ved bioprintning af flercellede vævSUTD leder en dybdegående gennemgang af den forestående virkelighed i 3D-trykte organer og analyserer de seneste resultater, begrænsninger og muligheder for fremtidig forskning. Kredit:SUTD 3D-bio -
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
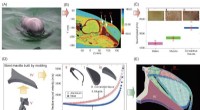 Kunstige materialer rekonstruerer marsvins ekkolokaliseringDesignet af den fysisk baserede fysiske model Kredit:©Science China Press Over millioner af år, Marsvin har udviklet kraftfulde biosonarer med høj nøjagtighed og intelligens til at detektere og sp
Kunstige materialer rekonstruerer marsvins ekkolokaliseringDesignet af den fysisk baserede fysiske model Kredit:©Science China Press Over millioner af år, Marsvin har udviklet kraftfulde biosonarer med høj nøjagtighed og intelligens til at detektere og sp
- Hvad er de vigtigste stjerner på Constellation Leo?
- Bolivia har mistet 1,7 millioner hektar til brand:regeringen
- Hvor mange atomer af ilt er der i 3al2o3?
- Hvad indeholder energidrikke og barer?
- Hvilke faseændringsresultater med øget kinetisk energi?
- Virker vores fiskerilovgivning? Bare spørg om gag grouper


