Hvad har et højere kogepunktvand eller ki?
Her er hvorfor:
* Intermolekylære kræfter: Ki er en ionisk forbindelse, hvilket betyder, at den har stærke elektrostatiske attraktioner mellem dens positivt ladede kaliumioner (K+) og negativt ladede iodidioner (I-). Disse stærke ioniske bindinger kræver en masse energi til at bryde, hvilket fører til et højt kogepunkt.
* vandets hydrogenbinding: Vand, mens det har et relativt højt kogepunkt på grund af hydrogenbinding mellem dets molekyler, har stadig svagere intermolekylære kræfter sammenlignet med de ioniske bindinger i KI.
kogepunkter:
* Vand:100 ° C (212 ° F)
* Ki:1330 ° C (2426 ° F)
Derfor har Ki et markant højere kogepunkt end vand.
 Varme artikler
Varme artikler
-
 Klatring af dråber kan føre til mere effektiv vandhøstningDr. Xianming Dai, assisterende professor i maskinteknik ved Erik Jonsson School of Engineering and Computer Science, og hans forskerhold har arbejdet på at udvikle teknologi, der høster rent vand fra
Klatring af dråber kan føre til mere effektiv vandhøstningDr. Xianming Dai, assisterende professor i maskinteknik ved Erik Jonsson School of Engineering and Computer Science, og hans forskerhold har arbejdet på at udvikle teknologi, der høster rent vand fra -
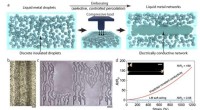 Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op
Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op -
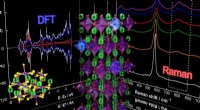 Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber
Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber -
 Forskere udvikler en unik metode til at skabe pulverkompositterKredit:Pixabay/CC0 Public Domain Forskere fra South Ural State University har udviklet en ny metode til at skabe pulvermetalkompositter. Metoden kan reducere spild og forbedre kvaliteten af elek
Forskere udvikler en unik metode til at skabe pulverkompositterKredit:Pixabay/CC0 Public Domain Forskere fra South Ural State University har udviklet en ny metode til at skabe pulvermetalkompositter. Metoden kan reducere spild og forbedre kvaliteten af elek
- Hvordan undervandsplanter og koraller kan hjælpe dyr med at overleve marine hedebølger
- Ny opdagelse understøtter genanvendelig hjelmpolstring
- Hvad er den kemiske formel for salt?
- Nyt Vacuum Solar Telescope afslører acceleration af magnetisk genforbindelse
- Hvordan findes klor ofte i naturen?
- Hvilke forbindelser er i brød?


