Hvordan produceres - nitrogenoxid?
1. Industriel produktion:
* Termisk nedbrydning af ammoniumnitrat: Dette er den mest almindelige industrielle metode. Ammoniumnitrat (NH₄no₃) opvarmes til en høj temperatur (ca. 250 ° C), hvilket får det til at nedbrydes til nitrogenoxid, vand og nitrogengas:
* Nh₄no₃ → N₂O + 2 H₂O
2. Laboratorieproduktion:
* reaktion af nitrater med ammoniumsalte: I en laboratorieindstilling kan en opløsning af ammoniumchlorid (NH₄CL) reages med natriumnitrat (nano₃) for at producere nitrogenoxid:
* NH₄CL + NANO₃ → N₂O + NaCl + 2 H₂O
3. Andre metoder:
* Oxidation af ammoniak: Nitrogenoxid kan også produceres ved at oxidere ammoniak (NH₃) i nærvær af ilt (O₂):
* 2 NH₃ + 2 O₂ → N₂O + 3 H₂O
* Nedbrydning af nitrosyre: Nitrosyre (HNO₂) kan nedbrydes til nitrogenoxid, vand og nitrogendioxid (NO₂):
* 3 Hno₂ → N₂O + HNO₃ + H₂O
Vigtige overvejelser:
* renhed: Renheden af produceret nitrogenoxid afhænger af den anvendte metode og kvaliteten af udgangsmaterialerne.
* sikkerhed: Produktion af nitrogenoxid involverer håndtering af kemikalier, der kan være farlige, hvis de ikke udføres korrekt. Det er vigtigt at bruge passende sikkerhedsforholdsregler og følge etablerede procedurer.
anvendelser:
* Medicinsk anæstesi: Nitrogenoxid bruges ofte som en tandbedøvelse såvel som i kirurgi og andre medicinske procedurer.
* aerosol drivmiddel: Det bruges som drivmiddel i pisket fløde og andre fødevarer.
* Automotive Fuel Additiv: Nogle racerbiler bruger nitrogenoxid som et brændstofadditiv for at øge effekten.
* forskning og industri: Nitrogenoxid bruges i forskellige forskningsapplikationer, såsom i studiet af forbrænding og atmosfærisk kemi.
Fortæl mig, hvis du har andre spørgsmål.
 Varme artikler
Varme artikler
-
 Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM -
 Ny undersøgelse afslører, at protonhydreringsstrukturer er asymmetriskeKredit:CC0 Public Domain Hvordan vand solvaterer og transporterer protoner er et grundlæggende spørgsmål, som både kemikere og biologer står over for, og det er afgørende for vores forståelse af p
Ny undersøgelse afslører, at protonhydreringsstrukturer er asymmetriskeKredit:CC0 Public Domain Hvordan vand solvaterer og transporterer protoner er et grundlæggende spørgsmål, som både kemikere og biologer står over for, og det er afgørende for vores forståelse af p -
 Her kommer solen:en ny ramme for kunstig fotosynteseKredit:RapidEye/iStock Forskere har længe forsøgt at efterligne den proces, hvorved planter fremstiller deres eget brændstof ved hjælp af sollys, carbondioxid, og vand gennem kunstige fotosyntesea
Her kommer solen:en ny ramme for kunstig fotosynteseKredit:RapidEye/iStock Forskere har længe forsøgt at efterligne den proces, hvorved planter fremstiller deres eget brændstof ved hjælp af sollys, carbondioxid, og vand gennem kunstige fotosyntesea -
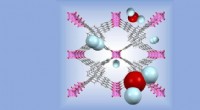 Meget modulære metal-organiske rammebaserede materialer viser et stort potentiale for fotokatalytis…Den metalorganiske ramme (grå og magenta gitter) kan bruge solenergi til at splitte vandmolekyler (røde og lyseblå kugler) til at frigive brint (lyseblå kugler). Kredit:2020 Nikita Kolobov En meta
Meget modulære metal-organiske rammebaserede materialer viser et stort potentiale for fotokatalytis…Den metalorganiske ramme (grå og magenta gitter) kan bruge solenergi til at splitte vandmolekyler (røde og lyseblå kugler) til at frigive brint (lyseblå kugler). Kredit:2020 Nikita Kolobov En meta
- Tre typer stenarter, der formes, når Lava Cools
- Forskere studerer chirale skyrmions adfærd i chirale blomsterlignende forhindringer
- CoronaChecks hjemmeside bekæmper spredning af misinformation
- Hvad er et andet navn for forbrugerne?
- Hvilken energi producerer en tromle?
- 5 Landbrugsteknologier, der ændrede verden


