Skriv den afbalancerede ligning for aluminiumshydroxid og natriumnitrat reagerer på produceret aluminium Tak, forklar venligst?
Aluminiumshydroxid og natriumnitrat reagerer ikke på produceret aluminium
* aluminium hydroxid (AL (OH) ₃) er en svag base.
* natriumnitrat (nano₃) er et salt, der er meget opløseligt i vand og generelt ureaktiv.
Disse to forbindelser, når de er blandet, reagerer ikke for at producere aluminiumsmetal (AL). Her er hvorfor:
1. ingen redoxreaktion: En reaktion, der ville producere aluminiumsmetal, ville kræve en reduktion af aluminium fra dens +3 oxidationstilstand i aluminiums hydroxid til dets 0 oxidationstilstand i elementært aluminium. Denne form for reaktion har brug for et stærkt reduktionsmiddel, og natriumnitrat er ikke stærk nok.
2. Ingen nedbør: Der er ikke dannet noget uopløseligt produkt, der ville føre reaktionen fremad. Både aluminiumnitrat (AL (NO₃) ₃) og natriumhydroxid (NaOH) er opløselige i vand.
Hvad sker der faktisk:
Hvis du blander aluminiumshydroxid og natriumnitrat, får du sandsynligvis en blanding af disse forbindelser opløst i vand. Der kan være et lille skift i ligevægt på grund af den svage basis af aluminiums hydroxid, men der vil ikke forekomme nogen signifikant reaktion.
At fremstille aluminiumsmetal:
For at fremstille aluminiumsmetal har du brug for en proces kaldet elektrolyse . Dette involverer anvendelse af elektricitet til at tvinge aluminiumioner i en smeltet saltopløsning for at få elektroner og blive aluminiumatomer.
Lad mig vide, om du gerne vil udforske andre kemiske reaktioner eller elektrolyseprocessen!
 Varme artikler
Varme artikler
-
 Næste generations insektmidler til at bekæmpe myggebårne sygdommeAnopheles gambiae myg, lever af blod. Kredit:James Gathany, Centre for Disease Control and Prevention Næsten 700 millioner mennesker lider af myggebårne sygdomme – såsom malaria, West Nile, Zika-
Næste generations insektmidler til at bekæmpe myggebårne sygdommeAnopheles gambiae myg, lever af blod. Kredit:James Gathany, Centre for Disease Control and Prevention Næsten 700 millioner mennesker lider af myggebårne sygdomme – såsom malaria, West Nile, Zika- -
 Forskere udvikler potentielt billige, lavemissionsteknologi, der kan omdanne metan uden at danne CO2Brintproduktion med en Ni-Bi smeltet katalysator Kredit:Brian Long Mens vi arbejder hen imod mere bæredygtige måder at styrke vores livsstil på, der er en søgen efter at bygge bro mellem de kuldio
Forskere udvikler potentielt billige, lavemissionsteknologi, der kan omdanne metan uden at danne CO2Brintproduktion med en Ni-Bi smeltet katalysator Kredit:Brian Long Mens vi arbejder hen imod mere bæredygtige måder at styrke vores livsstil på, der er en søgen efter at bygge bro mellem de kuldio -
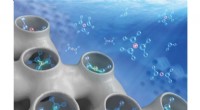 Afsløring af, hvordan vand og ioner påvirker kemiske reaktiviteter ved fast-vandige grænsefladerFå katalysatorer til at spille din melodi ved hjælp af vand- og vandbårne arter. Kredit:Chinese Journal of Catalysis Fast-vandige grænseflader er allestedsnærværende og essentielle i en bred vifte
Afsløring af, hvordan vand og ioner påvirker kemiske reaktiviteter ved fast-vandige grænsefladerFå katalysatorer til at spille din melodi ved hjælp af vand- og vandbårne arter. Kredit:Chinese Journal of Catalysis Fast-vandige grænseflader er allestedsnærværende og essentielle i en bred vifte -
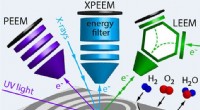 Tre mikroskoper ser mere end toGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.2c03692 Man skal se meget nøje for at forstå, hvilke processer der finder sted på overfladerne af katalysatorer. Faste katalysato
Tre mikroskoper ser mere end toGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.2c03692 Man skal se meget nøje for at forstå, hvilke processer der finder sted på overfladerne af katalysatorer. Faste katalysato
- Hvad er et rent stof, der ikke kan opdeles i andre stoffer på kemiske eller fysiske midler?
- Hvilke to egenskaber bestemmer, hvor stærk en krafttyngdekraft vil spille på genstande?
- Hvilken slags objekt vil udføre både varme og elektricitet?
- Hvad betyder den røde prik på Jupiter?
- Hvad er sammensætningen af Vega Star?
- Hvor er acceleration på grund af tyngdekraften større?


