Chloridionen har den samme valens som natrium, men det er en anden elektrovalens hvorfor?
Valency
* Valency henviser til kombinationskapaciteten af et atom eller ion. Det er et generelt udtryk, der beskriver, hvor mange bindinger et atom der kan dannes.
* Både natrium (NA) og chlor (CL) har en valens på 1. Dette betyder, at de kan danne en enkelt binding med et andet atom.
Elektrovalens
* Elektrovalens er antallet af elektroner, som et atom får eller mister for at danne en ion. Det er specifikt for ionisk binding.
* Natrium (NA) har en elektrovalens på +1, fordi det mister et elektron for at blive en positivt ladet ion (Na +).
* Chlor (CL) har en elektrovalens på -1, fordi det får et elektron til at blive en negativt ladet ion (Cl-).
Hvorfor forskellen?
Forskellen i elektrovalens stammer fra de forskellige måder, natrium og klor opnår en stabil elektronkonfiguration:
* natrium: Natrium har en elektron i sin yderste skal. Ved at miste denne elektron opnår det en stabil konfiguration med en fuld ydre skal (som den ædle gas neon).
* klor: Klor har syv elektroner i sin yderste skal. Ved at få en elektron opnår det også en stabil konfiguration med en fuld ydre skal (som den ædle gas -argon).
Kortfattet:
* Både natrium og klor har en valens på 1, hvilket betyder, at de kan danne en binding.
* Natrium mister et elektron for at blive Na + (elektrovalens +1).
* Klor får et elektron for at blive CL- (elektrovalens -1).
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Hvordan bakterier skaber en sparegris til de magre tiderCyanophycinbiosyntese ligner en vinduesvisker i aktion:et domæne er ansvarligt for at tilføje aspartat (Asp), et andet domæne er ansvarlig for at tilføje arginin (Arg), to nitrogenrige aminosyrer, og
Hvordan bakterier skaber en sparegris til de magre tiderCyanophycinbiosyntese ligner en vinduesvisker i aktion:et domæne er ansvarligt for at tilføje aspartat (Asp), et andet domæne er ansvarlig for at tilføje arginin (Arg), to nitrogenrige aminosyrer, og -
 Anatomi af en acnebehandlingKredit:CC0 Public Domain Sarecyclin, et lægemiddel godkendt til brug i USA i 2018, er det første nye antibiotikum godkendt til behandling af acne i mere end 40 år. Nu, forskere ved Yale og Univers
Anatomi af en acnebehandlingKredit:CC0 Public Domain Sarecyclin, et lægemiddel godkendt til brug i USA i 2018, er det første nye antibiotikum godkendt til behandling af acne i mere end 40 år. Nu, forskere ved Yale og Univers -
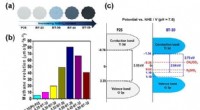 Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der
Meget effektiv fotokatalysator, der omdanner kuldioxid til metan(a) Figuren viser farveændringen af fotokatalysatoren udviklet af forskerholdet. Den viser, at den reducerede titaniumdioxid absorberer lys mere mod højre, og farven bliver mørkere.(b) En graf, der -
 Forskere udvikler en bæredygtig metode til at udvinde vanillin fra træforarbejdningsaffaldEn elektrolysecelle udviklet på JGU til udvinding af vanillin fra lignin. Kredit:Michael Zirbes Forskere ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en ny bæredygtig meto
Forskere udvikler en bæredygtig metode til at udvinde vanillin fra træforarbejdningsaffaldEn elektrolysecelle udviklet på JGU til udvinding af vanillin fra lignin. Kredit:Michael Zirbes Forskere ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en ny bæredygtig meto
- Arven fra NASAs daggry, nær slutningen af sin mission
- Mikroskop kombinerer konfokal mikrospektroskopi og 3-D scanning sonde nanotomografi
- Er udåndet luft en sammensat blanding eller element?
- Hvad er et mål for de gennemsnitlige energi tilfældige bevægelsespartikler?
- Hvilket lag af jorden er sammensat af fast nikkel og jern?
- Tilhører alle atomer, der har det samme antal protoner, det samme element?


