Hvilken type binding er mellem kobber og svovl?
Her er hvorfor:
* kobber (cu) er et metal, og metaller har en tendens til at miste elektroner til dannelse af positivt ladede ioner (kationer).
* svovl (r) er en ikke -metal, og ikke -metaller har en tendens til at få elektroner til at danne negativt ladede ioner (anioner).
I en forbindelse som kobbersulfid (CUS) mister kobber en eller to elektroner for at blive en cu⁺ eller cu²⁺ion. Svovl får to elektroner for at blive en s²⁻ion. De modsatte ladninger af ionerne tiltrækker hinanden og skaber en elektrostatisk kraft, der holder ionerne sammen i en gitterstruktur. Denne elektrostatiske kraft er det, vi kalder en ionisk binding.
 Varme artikler
Varme artikler
-
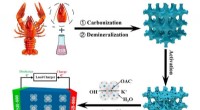 Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd
Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd -
 Påvisning af en ny reaktionsvej i atmosfærenPå TROPOS i Leipzig, holdet lykkedes med at demonstrere denne proces i laboratorieforsøg ved hjælp af et specielt flowapparat, der tillader interferensfrie eksperimenter med gasfasereaktioner ved atmo
Påvisning af en ny reaktionsvej i atmosfærenPå TROPOS i Leipzig, holdet lykkedes med at demonstrere denne proces i laboratorieforsøg ved hjælp af et specielt flowapparat, der tillader interferensfrie eksperimenter med gasfasereaktioner ved atmo -
 Opdagelse af en ny strukturfamilie af oxid-ion-ledere SrYbInO4Strukturfeltkortet viser 209 forskellige sammensætninger af M2MO4-forbindelser, hvor det røde skraverede område repræsenterer strukturfeltet af CaFe2O4-typen. Den nyligt syntetiserede forbindelse SrYb
Opdagelse af en ny strukturfamilie af oxid-ion-ledere SrYbInO4Strukturfeltkortet viser 209 forskellige sammensætninger af M2MO4-forbindelser, hvor det røde skraverede område repræsenterer strukturfeltet af CaFe2O4-typen. Den nyligt syntetiserede forbindelse SrYb -
 Fotokrome vismutkomplekser viser et stort løfte for optiske hukommelseselementerKredit:Pixabay/CC0 Public Domain Russiske kemikere har fået et nyt fotokromt kompleks bestående af vismut (III) og viologenkationer og brugt den nye forbindelse til at skabe optiske hukommelsesele
Fotokrome vismutkomplekser viser et stort løfte for optiske hukommelseselementerKredit:Pixabay/CC0 Public Domain Russiske kemikere har fået et nyt fotokromt kompleks bestående af vismut (III) og viologenkationer og brugt den nye forbindelse til at skabe optiske hukommelsesele
- Bæredygtig kemisk syntese med platin
- Forskning afslører nøglen til at reducere radikalisering af fængsler
- Hvad er pH-niveauet i flydende sæbe?
- Antropologs kortlægningsprojekt viser, hvordan Peru transformerede sig efter koloniseringen
- Er kovalent det samme som makromolekylært?
- Hvordan skriver du zinkreaktioner med vandig saltsyre for at producere II -chlorid og brintgas?


