Hvorfor er klor en gas ved stuetemperatur, men natriumchloridens fast temperatur?
* Intermolekylære kræfter: Typen og styrken af intermolekylære kræfter mellem molekyler bestemmer et stofs stofstilstand.
* klor (cl₂): Klormolekyler holdes sammen af svage London -spredningskræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling, hvilket fører til svage attraktioner. Da disse kræfter er svage, kan klormolekyler let bevæge sig fra hinanden, hvilket gør det til en gas ved stuetemperatur.
* natriumchlorid (NaCl): Natriumchlorid er en ionisk forbindelse. Det dannes gennem en stærk elektrostatisk attraktion mellem positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻). Disse ioniske bindinger er meget stærkere end de intermolekylære kræfter i klor. Denne stærke attraktion holder ionerne tæt pakket i en krystalgitterstruktur, hvilket gør natriumchlorid til et fast stof ved stuetemperatur.
* molekylær struktur:
* klor: Klor findes som et diatomisk molekyle (CL₂). Molekylets relativt lille størrelse og ikke -polære karakter bidrager til de svage intermolekylære kræfter.
* natriumchlorid: Natriumchlorid danner en tredimensionel krystalgitterstruktur. De stærke ioniske bindinger strækker sig gennem hele strukturen og holder ionerne fast på plads.
Kortfattet: De stærke ioniske bindinger i natriumchlorid skaber en stiv, fast struktur, mens de svage intermolekylære kræfter i klor giver den mulighed for at eksistere som en gas ved stuetemperatur.
Sidste artikelHvilke reaktanter ville give kaliumnitratkuldioxidvand?
Næste artikelBliver kobber II -klorid blåt i vand?
 Varme artikler
Varme artikler
-
 Nye keramiske nanofiber svampe kan bruges til fleksibel isolering, vandrensningForskere har udviklet et svampelignende materiale fremstillet af keramiske nanofibre. Materialet bevarer den varmebestandighed, der gør keramik nyttig i højtemperaturindstillinger, men er også meget d
Nye keramiske nanofiber svampe kan bruges til fleksibel isolering, vandrensningForskere har udviklet et svampelignende materiale fremstillet af keramiske nanofibre. Materialet bevarer den varmebestandighed, der gør keramik nyttig i højtemperaturindstillinger, men er også meget d -
 Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ
Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ -
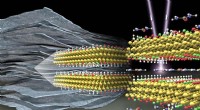 Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u
Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u -
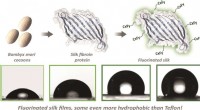 Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand,
Forskere bruger modificerede silkeproteiner til at skabe nye nonstick-overfladerGrafisk abstrakt. Kredit:ChemBioChem (2022). DOI:10.1002/cbic.202200429 Forskere ved Tufts University har udviklet en metode til at lave silkebaserede materialer, der nægter at holde sig til vand,
- Den nærmeste planet, der nogensinde er opdaget uden for solsystemet, kunne være beboelig med et ha…
- Forskere viser, at solens magnetiske aktivitet påvirker bestemmelsen af dens seismiske alder
- Er magtenergi den bedste for fremtiden?
- Hvad er atmosfæren set af Jorden og et pigens navn?
- Af hvilken grund indsamlede de indre planeter ikke gas, som Giants gjorde?
- Hvordan dannes porphyritiske klipper?


