Hvad står SBBR3 for, og er den kovalent eller ionisk?
Det er en kovalent forbindelse.
Her er hvorfor:
* Elektronegativitetsforskel: Elektronegativitetsforskellen mellem antimon (SB) og brom (BR) er ikke stor nok til at danne en rent ionisk binding. Antimon har en elektronegativitet på 2,05, mens brom har en elektronegativitet på 2,96. Denne forskel (0,91) falder i området for polære kovalente bindinger.
* Naturen af elementerne: Antimon er en metalloid, og brom er en ikke -metal. Mens metalloider undertiden kan danne ioniske forbindelser med ikke -metaller, er bindingen i dette tilfælde primært kovalent.
I SBBR3 deler bromatomerne elektroner med antimonatomet og danner kovalente bindinger. Dette resulterer i et molekyle med en trigonal pyramidal form.
 Varme artikler
Varme artikler
-
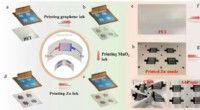 Høj sikkerhed, fleksible og skalerbare genopladelige plane mikrobatterierSkematisk serigrafifremstilling af trykte Zn//MnO2 MBer og optiske fotografier, der viser den trinvise trykfremstilling af Zn//MnO2 MBer.(ad) Skematisk serigrafifremstilling af trykte Zn//MnO2 MBer:(a
Høj sikkerhed, fleksible og skalerbare genopladelige plane mikrobatterierSkematisk serigrafifremstilling af trykte Zn//MnO2 MBer og optiske fotografier, der viser den trinvise trykfremstilling af Zn//MnO2 MBer.(ad) Skematisk serigrafifremstilling af trykte Zn//MnO2 MBer:(a -
 Nanokapsler muliggør celleinspirerede metaboliske reaktionerSkematisk illustration af det biokatalytiske nanorum med indkapslet enzym phosphoglucomutase til omdannelse af glucose-1-phosphat (blå cirkler) til det ønskede produkt glucose-6-phosphat (orange cirkl
Nanokapsler muliggør celleinspirerede metaboliske reaktionerSkematisk illustration af det biokatalytiske nanorum med indkapslet enzym phosphoglucomutase til omdannelse af glucose-1-phosphat (blå cirkler) til det ønskede produkt glucose-6-phosphat (orange cirkl -
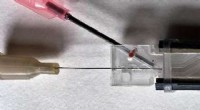 AdskillelseslinjeKredit:Erin Dauson, Institut for Civil- og Miljøteknik, Carnegie Mellon University For patienter med behov for blod, det er fatalt vigtigt, at de modtager den rigtige type. Derfor vil læger ofte g
AdskillelseslinjeKredit:Erin Dauson, Institut for Civil- og Miljøteknik, Carnegie Mellon University For patienter med behov for blod, det er fatalt vigtigt, at de modtager den rigtige type. Derfor vil læger ofte g -
 Reduktion af fælder øger ydeevnen af organiske fotodetektorerFleksible organiske fotodetektorer (OPDer) har et enormt potentiale for applikationer inden for billig billedbehandling, sundhedsovervågning og nær infrarød sensing. Kredit:Christian Körner Fysike
Reduktion af fælder øger ydeevnen af organiske fotodetektorerFleksible organiske fotodetektorer (OPDer) har et enormt potentiale for applikationer inden for billig billedbehandling, sundhedsovervågning og nær infrarød sensing. Kredit:Christian Körner Fysike
- I henhold til loven har de hotteste stjerner også?
- Hvilken proces overfører energi fra den varme overflade af jord til luftpartikler i atmosfæren?
- Hvad er aktiv energiimport?
- Hvad er et gasrør, der bruges til i videnskab?
- Er dette sandt eller falsk geotermisk energi er en ubegrænset kilde til billig energi?
- Når et objekt frigøres i en væske, er trækkraften mindre end dens vægt, før den når terminalh…


