Hvorfor opfører glukose og natriumchlorid osmotisk allieret?
1. Dissociation:
* natriumchlorid (NaCl): Er en ionisk forbindelse, der dissocierer i to ioner (Na+ og Cl-), når de opløstes i vand. Dette betyder, at et molekyle af NaCl producerer to partikler i opløsning.
* glukose (C6H12O6): Er en kovalent forbindelse, der ikke adskiller sig i vand. Et molekyle af glukose forbliver som en enkelt partikel i opløsning.
2. Osmotisk tryk:
* osmotisk tryk er det krævede tryk for at forhindre den indre strøm af vand på tværs af en semipermeabel membran. Det er direkte proportionalt med koncentrationen af opløste partikler.
* NaCl: På grund af dens dissociation producerer en 1M -opløsning af NaCI 2 m opløste partikler. Dette resulterer i et højere osmotisk tryk sammenlignet med en 1M glukoseopløsning.
* glukose: Da den ikke adskiller sig, forbliver en 1M glukoseløsning som 1 m af opløste partikler.
3. Effekt på vandbevægelse:
* højt osmotisk tryk: Opløsninger med højere osmotisk tryk (som NaCl -opløsninger) trækker vand fra opløsninger med lavere osmotisk tryk (som rent vand eller fortyndede glukoseløsninger) på tværs af en semipermeabel membran.
* lavt osmotisk tryk: Opløsninger med lavere osmotisk tryk vil miste vand til opløsninger med højere osmotisk tryk.
Kortfattet:
* NaCl: Opløses i to partikler pr. Molekyle, hvilket skaber et højere osmotisk tryk og stærkere vandtegningseffekt.
* glukose: Forbliver som en partikel pr. Molekyle, hvilket resulterer i lavere osmotisk tryk og en svagere vandtegningseffekt.
Praktisk eksempel:
Hvis du placerer et rødt blodlegemer i en 1M NaCl -opløsning, vil det høje osmotiske tryk uden for cellen få vand til at skynde sig ud af cellen, hvilket fører til crenation (krympning). I modsætning hertil vil en rød blodlegemer i en 1M glukoseopløsning opleve mindre vandtab på grund af det nedre osmotiske tryk fra glukoseopløsningen.
Sidste artikelHvad er den empiriske formel for sammensat x3y12?
Næste artikelEr benzen mere opløselig i hexan end glycerol?
 Varme artikler
Varme artikler
-
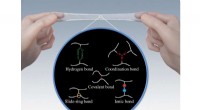 Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi
Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi -
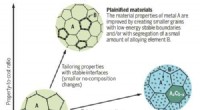 Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn -
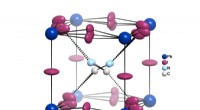 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
 Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo
Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo


