Hvad er forskellen mellem sulfit og svovltrioxid?
sulfit (so₃²⁻)
* Kemisk formel: So₃²⁻
* struktur: Et svovlatom (er) bundet til tre iltatomer (O) med en negativ to ladning.
* egenskaber:
* Findes som en ion i opløsning eller i salte (sulfitter).
* Et almindeligt reduktionsmiddel.
* Brugt som fødevarekonserveringsmiddel til at forhindre oxidation og bruning.
* Eksempler: Natriumsulfit (na₂so₃), kaliumsulfit (k₂so₃)
svovltrioxid (SO₃)
* Kemisk formel: Så₃
* struktur: Et svovlatom (er) bundet til tre iltatomer (O) uden nogen samlet ladning.
* egenskaber:
* Eksisterer som en farveløs gas ved stuetemperatur.
* Meget reaktiv og et stærkt oxidationsmiddel.
* Opløser i vand til dannelse af svovlsyre (H₂so₄).
* Et vigtigt mellemprodukt i produktionen af svovlsyre.
* En større luftforurenende stof, der bidrager til surt regn.
Nøgleforskelle:
* opladning: Sulfit er en ion med en -2 -ladning, mens svovltrioxid er et neutralt molekyle.
* reaktivitet: Svovltrioxid er langt mere reaktiv end sulfit.
* applikationer: Sulfitter anvendes som konserveringsmidler, mens svovltrioxid er et vigtigt industrikemikalie, der bruges til produktion af svovlsyre.
Kortfattet:
Mens både sulfit- og svovltrioxid indeholder svovl og ilt, er deres kemiske egenskaber og anvendelser markant forskellige på grund af deres forskellige kemiske strukturer og ladninger.
Sidste artikelHvad er 3 måder at fremstille brint på?
Næste artikelHvad er Color Iron II hydroxid?
 Varme artikler
Varme artikler
-
 Forskere opfinder processen til fremstilling af bæredygtigt gummi, plastikVores team kombinerede en katalysator, vi for nylig har opdaget, med ny og spændende kemi for at finde det første høje udbytte, lavprismetode til fremstilling af butadien, siger Dionisios Vlachos, Dir
Forskere opfinder processen til fremstilling af bæredygtigt gummi, plastikVores team kombinerede en katalysator, vi for nylig har opdaget, med ny og spændende kemi for at finde det første høje udbytte, lavprismetode til fremstilling af butadien, siger Dionisios Vlachos, Dir -
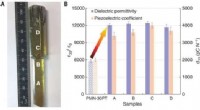 Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. (
Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. ( -
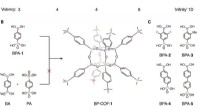 Ny kovalent organisk ramme, der bruger bor og fosfor, giver mulighed for bedre tilslutningHøjere valens i COFer og syntetisk strategi for polycubaner. (A) Bygningsenheder med valens 3 og 4 bruges i øjeblikket i design og syntese af 3D COFer; terninger med valens på 8 og uendelige 1D-stænge
Ny kovalent organisk ramme, der bruger bor og fosfor, giver mulighed for bedre tilslutningHøjere valens i COFer og syntetisk strategi for polycubaner. (A) Bygningsenheder med valens 3 og 4 bruges i øjeblikket i design og syntese af 3D COFer; terninger med valens på 8 og uendelige 1D-stænge -
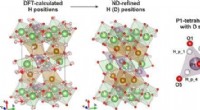 Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel
Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel
- Brug af frøskum som et antiseptisk leveringssystem
- Hvad bruges det elektroniske udstyr til at måle temperatur?
- Hvordan fungerer Drysol?
- Nyt materiale lover hurtigere elektronik
- Hvilken slags ioner bliver et natriumatom og klor, når valanceelektron overføres til den anden?
- Spidse spidser på aluminium blæksprutter øger den katalytiske reaktivitet


