Hver gang ammoniak donerer et elektronpar til dannelse af en kovalent binding fungerer det som en?
Her er hvorfor:
* Lewis Base: En Lewis -base er en art, der donerer et elektronpar.
* Ammoniaks ensomme par: Ammoniak har et ensomt par elektroner på nitrogenatomet.
* kovalent obligationsdannelse: Når ammoniak danner en kovalent binding, deler den sit ensomme par med et andet atom, hvilket effektivt donerer elektronparret.
Eksempel: I reaktionen af ammoniak med hydrogenchlorid (HCI) fungerer ammoniak som en Lewis -base ved at donere dets ensomme par til hydrogenion (H⁺) fra HCI. Dette danner en ammoniumion (NH₄⁺) og en chloridion (CL⁻).
NH₃ + HCL → NH₄⁺ + CL⁻
 Varme artikler
Varme artikler
-
 Selvsamlende peptider og kampen mod fedme og diabetesFibriller af peptidhormonet Oxyntomodulin, med diametre fra ~6 til 40 nm. Kredit:S. Kinna Et samarbejde mellem Afdelingens Nanoscience Center og MedImmune tager store skridt mod en sikrere og mere
Selvsamlende peptider og kampen mod fedme og diabetesFibriller af peptidhormonet Oxyntomodulin, med diametre fra ~6 til 40 nm. Kredit:S. Kinna Et samarbejde mellem Afdelingens Nanoscience Center og MedImmune tager store skridt mod en sikrere og mere -
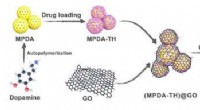 Cellulose nanofibril-baseret indkapslingsstruktur til at kontrollere lægemiddelfrigivelseDesignet af MPDA@GO/CNF-indkapslingsstrukturen og applikationen til kontrolleret lægemiddelfrigivelse. Kredit:LIU Yingying Intelligente hydrogeler med flere funktioner såsom vedvarende lægemiddelf
Cellulose nanofibril-baseret indkapslingsstruktur til at kontrollere lægemiddelfrigivelseDesignet af MPDA@GO/CNF-indkapslingsstrukturen og applikationen til kontrolleret lægemiddelfrigivelse. Kredit:LIU Yingying Intelligente hydrogeler med flere funktioner såsom vedvarende lægemiddelf -
 At dyrke en startup med stor påvirkning fra en lillebitte svampChain Reaction Innovation-iværksætterne Justin Whiteley og Tyler Huggins arbejder sammen med Argonne-forskeren Meltem Urgun-Demirtas i et Energy Systems Divisions laboratorium for at vokse tunable, hø
At dyrke en startup med stor påvirkning fra en lillebitte svampChain Reaction Innovation-iværksætterne Justin Whiteley og Tyler Huggins arbejder sammen med Argonne-forskeren Meltem Urgun-Demirtas i et Energy Systems Divisions laboratorium for at vokse tunable, hø -
 Ny syntetisk rute til produktion af biobrændstofferDet Bochum-baserede katalyseteam:Baoxiang Peng (til venstre) og Martin Muhler. Kredit:RUB, Rohlf Et tysk-kinesisk forskerhold har fundet en ny syntetisk rute til fremstilling af biobrændstof fra b
Ny syntetisk rute til produktion af biobrændstofferDet Bochum-baserede katalyseteam:Baoxiang Peng (til venstre) og Martin Muhler. Kredit:RUB, Rohlf Et tysk-kinesisk forskerhold har fundet en ny syntetisk rute til fremstilling af biobrændstof fra b


