Når et metal og en ikke-metal kombineres, hvad fremstilles de solide?
Her er hvorfor:
* metaller har en tendens til at miste elektroner og blive positivt ladede ioner (kationer).
* ikke-metaler har en tendens til at vinde elektroner og blive negativt ladede ioner (anioner).
Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner er det, der danner den ioniske binding og skaber den faste ioniske forbindelse.
Eksempler på ioniske forbindelser:
* natriumchlorid (NaCl) :Natrium (Na, et metal) mister et elektron til klor (CL, en ikke-metal), der danner Na+ og Cl-ioner, som derefter tiltrækker hinanden til at danne det salt, vi kender.
* calciumoxid (CAO) :Calcium (Ca, et metal) mister to elektroner til ilt (O, en ikke-metal), danner Ca2+ og O2-ioner, som derefter tiltrækker hinanden.
Bemærk: Der er undtagelser fra denne regel, hvor metal-ikke-kombinationer kan danne kovalente forbindelser. Dette sker, når elektronegativitetsforskellen mellem metallet og ikke-metal er lille. Imidlertid er ioniske forbindelser langt mere almindelige.
 Varme artikler
Varme artikler
-
 Ingeniører udvikler et programmerbart camouflerende materiale inspireret af blækspruttehudSepia apama (gigantisk australsk blæksprutte), der udtrykker sine papiller til camouflageformål. Kredit:Roger Hanlon Til blæksprutten og blæksprutten, Øjeblikkeligt at ændre deres hudfarve og møn
Ingeniører udvikler et programmerbart camouflerende materiale inspireret af blækspruttehudSepia apama (gigantisk australsk blæksprutte), der udtrykker sine papiller til camouflageformål. Kredit:Roger Hanlon Til blæksprutten og blæksprutten, Øjeblikkeligt at ændre deres hudfarve og møn -
 Forskere tager et nyt kig på Michaelis-Menten-ligningenMagnus Kjærgaard (til venstre) og Mateusz Dyla udfordrer en af hjørnestenene i biokemi, Michaelis-Menten-ligningen, da de viser, at mange enzymer i signalveje er uafhængige af substratkoncentration,
Forskere tager et nyt kig på Michaelis-Menten-ligningenMagnus Kjærgaard (til venstre) og Mateusz Dyla udfordrer en af hjørnestenene i biokemi, Michaelis-Menten-ligningen, da de viser, at mange enzymer i signalveje er uafhængige af substratkoncentration, -
 Nobel Kemi-pristager siger, at den første forhindring var frygt for mørkeDen schweiziske videnskabsmand Jacques Dubochet var en af tre tildelt Nobels kemipris for kryo-elektronmikroskopi, en enklere og bedre metode til billeddannelse af små, frosne molekyler Længe fø
Nobel Kemi-pristager siger, at den første forhindring var frygt for mørkeDen schweiziske videnskabsmand Jacques Dubochet var en af tre tildelt Nobels kemipris for kryo-elektronmikroskopi, en enklere og bedre metode til billeddannelse af små, frosne molekyler Længe fø -
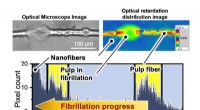 Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri
Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri
- Hvilken type bevægelse er den vandrette bevægelse et projektil?
- Hvad er de to målesystem, og hvordan adskiller de sig?
- Hvorfor virker Mars som den mest sandsynlige planet for mennesker at besøge?
- Forskere skaber ny lystilstand
- Undersøgelse giver ny indsigt i oprindelsen af canadiske Rockies
- Hvilken styrke holder planeterne i bevægelse?


