Hvad er bindingen i diatomisk fluormolekyle F2 kaldet, og hvad ellers hydroxidion oh-kaldet?
* f2 (diatomisk fluor): Obligationen i F2 kaldes en kovalent obligation . Dette skyldes, at de to fluoratomer deler deres elektroner for at opnå en stabil elektronkonfiguration. De er ikke -polære kovalente bindinger, fordi elektronerne deles lige mellem de to identiske fluoratomer.
* oh- (hydroxidion): Hydroxidionen kaldes en ionisk forbindelse . Dette skyldes, at iltatomet har fået en ekstra elektron, hvilket giver det en negativ ladning (-1), mens brintatomet har mistet sin elektron, hvilket giver det en positiv ladning (+1). De modsatte ladninger tiltrækker og danner en ionisk binding.
Kortfattet:
* f2: Kovalent binding (ikke -polær)
* åh-: Ionisk forbindelse
Sidste artikelHvad er den mest almindelige inerte gas i atmosfæren?
Næste artikelHvordan har arbejdet fra kemikere påvirket miljøårene?
 Varme artikler
Varme artikler
-
 Molybdæn titanium carbid levedygtig i additiv fremstillingORNL-forskere brugte elektronstrålepulverlejefusion til at producere ildfast metalmolybdæn, som forblev revnefri og tæt, beviser sin levedygtighed for additive fremstillingsapplikationer. Kredit:ORNL/
Molybdæn titanium carbid levedygtig i additiv fremstillingORNL-forskere brugte elektronstrålepulverlejefusion til at producere ildfast metalmolybdæn, som forblev revnefri og tæt, beviser sin levedygtighed for additive fremstillingsapplikationer. Kredit:ORNL/ -
 Molekylær lim gør perovskite solceller dramatisk mere pålidelige over tidForskere har brugt selvsamlet monolags molekylær lim til at styrke grænseflader i perovskite solceller for at gøre dem mere effektive, stabil og pålidelig. Kredit:Padture lab/Brown University Et f
Molekylær lim gør perovskite solceller dramatisk mere pålidelige over tidForskere har brugt selvsamlet monolags molekylær lim til at styrke grænseflader i perovskite solceller for at gøre dem mere effektive, stabil og pålidelig. Kredit:Padture lab/Brown University Et f -
 Lab-on-a-disc-teknologi lover at fremskynde, forenkle DNA-analyse på stedetKredit:University of Virginia Mindre, hurtigere, lettere, billigere - det er mantraet fra University of Virginias biokemiker og spæde ingeniør James Landers. Han bruger et treårigt tilskud fra de
Lab-on-a-disc-teknologi lover at fremskynde, forenkle DNA-analyse på stedetKredit:University of Virginia Mindre, hurtigere, lettere, billigere - det er mantraet fra University of Virginias biokemiker og spæde ingeniør James Landers. Han bruger et treårigt tilskud fra de -
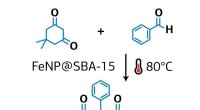 Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
- Hvor mange mol brint skal der til for at lave 36 gram vand?
- Forberedelse til ekstreme havniveauer afhænger af placering, tid, undersøgelse finder
- Bøn Mantis Fakta for Kids
- Hvordan at tænke som et vandskelsystem kan hjælpe med at redde Narragansett Bay
- Kølere katalysatorer:Renere luft til alle
- Hvad sker der med et massenummer, når det skubber alfa -partikel ud?


