Hvad er mere reaktivt silicium eller klor?
reaktivitet henviser til et stofs tendens til at gennemgå kemiske reaktioner.
klor er en meget reaktiv ikke -metal, der let danner kemiske bindinger. Det er et stærkt oxidationsmiddel, hvilket betyder, at det let får elektroner. Denne høje reaktivitet skyldes dens elektronegativitet og tilstedeværelsen af syv valenselektroner, hvilket gør den ivrig efter at afslutte sin oktet.
silicium på den anden side er en metalloid med en moderat reaktivitet. Det er mindre reaktivt end klor, fordi det har en lavere elektronegativitet og færre valenselektroner.
Her er nogle grunde til, at klor er mere reaktiv end silicium:
* Elektronegativitet: Chlor har en højere elektronegativitet (3,16) end silicium (1,90), hvilket indikerer en større tendens til at tiltrække elektroner.
* Valenselektroner: Klor har syv valenselektroner, mens silicium har fire. Klor er mere tilbøjelig til at få et elektron for at opnå en stabil oktet.
* atomstørrelse: Klor er mindre end silicium, hvilket gør dets valenselektroner mere tilgængelige til binding.
Konklusion:
Chlor er et meget reaktivt element på grund af dets høje elektronegativitet, syv valenselektroner og mindre atomstørrelse. Silicium er på den anden side mindre reaktiv på grund af dens lavere elektronegativitet og færre valenselektroner.
 Varme artikler
Varme artikler
-
 Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld
Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld -
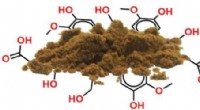 Plastik fra træ? Røntgenanalyse viser vej til ligninbaserede komponenter fremstillet efter målLignin er et lovende råmateriale (til venstre) til termoplastproduktion (til højre). Kredit:KTH Stockholm, Marcus Jawerth Biopolymeren lignin er et biprodukt fra papirfremstilling og et lovende rå
Plastik fra træ? Røntgenanalyse viser vej til ligninbaserede komponenter fremstillet efter målLignin er et lovende råmateriale (til venstre) til termoplastproduktion (til højre). Kredit:KTH Stockholm, Marcus Jawerth Biopolymeren lignin er et biprodukt fra papirfremstilling og et lovende rå -
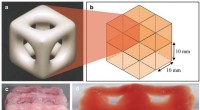 3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for
3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for -
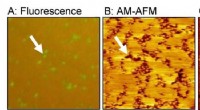 Samling af fluktuerende molekyler i kunstig cellemembranSe er lipiddobbeltlagsdomæner rige på polyethylenglycol (PEG)-modificeret lipid. (A) Fluorescensbillede, (B) amplitudemodulation (AM) AFM-topografi, og (C) frekvensmodulation (FM) AFM-topografi. Kredi
Samling af fluktuerende molekyler i kunstig cellemembranSe er lipiddobbeltlagsdomæner rige på polyethylenglycol (PEG)-modificeret lipid. (A) Fluorescensbillede, (B) amplitudemodulation (AM) AFM-topografi, og (C) frekvensmodulation (FM) AFM-topografi. Kredi
- Hvor kommer energien til translokation fra?
- Ny metode opnår 4D-billeddannelse af væsker i porer
- Bestemmelse af jordens tyngdekraftfelt mere præcist end nogensinde før
- Hvad er energi, der frigiver dele af en celle?
- Hvad er formlen for Ilkovic -ligning i diffusionsstrøm?
- Solsystemets alder kan etableres ved radioaktiv datering af?


