Er svovl mere reaktivt end nitrogen?
* Elektronkonfiguration: Svovl har seks valenselektroner, hvilket gør det mere sandsynligt at få to elektroner for at opnå en stabil octet -konfiguration. Nitrogen med fem valenselektroner skal få tre elektroner, hvilket kræver mere energi.
* Elektronegativitet: Svovl er mindre elektronegativ end nitrogen. Dette betyder, at svovl er mere villig til at miste elektroner og deltage i kemiske reaktioner.
* obligationsstyrke: N-N-tredobbeltbindingen i nitrogengas (N₂) er utroligt stærk, hvilket gør nitrogen meget ureaktiv. Svovl danner på den anden side svagere S-S-bindinger.
* Oxidation siger: Svovl udviser et bredere oxidationsområde end nitrogen, hvilket indikerer en større tilbøjelighed til at vinde eller miste elektroner.
Det er dog vigtigt at bemærke, at reaktivitet afhænger af specifikke betingelser:
* Temperatur: Nitrogen kan blive meget reaktiv ved ekstremt høje temperaturer.
* tilstedeværelse af katalysatorer: Specifikke katalysatorer kan fremme reaktioner, der involverer nitrogen.
Samlet set betragtes svovl under normale forhold som mere reaktiv end nitrogen på grund af dets elektroniske struktur og bindingsegenskaber.
Sidste artikelHvilken proces er ansvarlig for at ændre vand til damp?
Næste artikelHvad er de vigtigste gasser, der forårsager surt regn?
 Varme artikler
Varme artikler
-
 Forskere designer nyt responsivt porøst materiale inspireret af proteinerDen strukturelle fleksibilitet af ZnGGH i forbindelse med et konformationelt energilandskab Kredit:University of Liverpool Forskere fra University of Liverpool har, for første gang, syntetiserede
Forskere designer nyt responsivt porøst materiale inspireret af proteinerDen strukturelle fleksibilitet af ZnGGH i forbindelse med et konformationelt energilandskab Kredit:University of Liverpool Forskere fra University of Liverpool har, for første gang, syntetiserede -
 Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri
Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri -
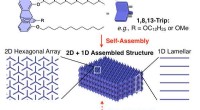 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles -
 Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0
Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0
- Hvordan kan astronomer opdage et sort hul, hvis det er usynligt for et optisk teleskop?
- Hvor bittert koldt vinterudbrud og en opvarmende planet vil tygge Lake Michigans kystlinje
- Hvad er et ikke -eksempel på energipryamid?
- Hvad er fysik naturligt en del af?
- Hvorfor skorpegassen?
- Hvor mange timers dagslys og mørke har Mars?


