Forklar, hvorfor kulstofchlorbindingsfotodissociates og fluor ikke gør det?
1. Obligationsstyrke:
* C-CL Bond: C-CL-bindingen er svagere end C-F-bindingen på grund af den større størrelse af klor sammenlignet med fluor. Dette betyder, at der kræves mindre energi for at bryde C-CL-bindingen.
* C-F-obligation: C-F-bindingen er meget stærk på grund af den lille størrelse og høje elektronegativitet af fluor, hvilket gør det vanskeligere at bryde.
2. Energy of Incident Light:
* UV -lys: Fotodissociation forekommer typisk, når molekyler udsættes for ultraviolet (UV) lys. Energien fra UV-fotoner er tilstrækkelig til at bryde den svagere C-CL-binding.
* Højere energilys: At bryde den stærkere C-F-binding kræver endnu højere energifotoner, ofte i området langt UV- eller røntgenstråle, som er mindre almindelige i typiske miljøer.
Kortfattet:
* C-CL Bond: Den relativt svage binding og energien fra UV -lys er tilstrækkelig til at forårsage fotodissociation.
* C-F-obligation: Den stærke binding kræver højere energilys for at bryde, hvilket er mindre let tilgængeligt, hvilket gør fotodissociation mindre sandsynlig.
Eksempel:
Chlorofluorcarbons (CFC'er) er kendt for deres evne til at udtømme ozonlaget gennem fotodissociation. Når de udsættes for UV-lys, bryder C-CL-bindingen i CFC'er, hvilket frigiver kloratomer, der katalyserer ødelæggelsen af ozonmolekyler. C-F-bindingerne i disse molekyler forbliver imidlertid intakte, hvilket bidrager til stabiliteten af CFC'er.
Afslutningsvis stammer den forskellige fotodissocieringsadfærd for C-CL og C-F-bindinger fra deres kontrasterende bindingsstyrker og den energi, der kræves for at bryde dem. Denne forskel i bindingsstyrke er afgørende for at forstå de miljømæssige konsekvenser af disse molekyler.
 Varme artikler
Varme artikler
-
 Fra mælkeprotein, et plastikskum, der bliver bedre i et hårdt miljøFra venstre mod højre, skummaterialer bestående af valle, polyurethan, polystyren, polyethylen og polystyren. Den øverste række repræsenterer ueksponerede materialer, og den nederste række repræsenter
Fra mælkeprotein, et plastikskum, der bliver bedre i et hårdt miljøFra venstre mod højre, skummaterialer bestående af valle, polyurethan, polystyren, polyethylen og polystyren. Den øverste række repræsenterer ueksponerede materialer, og den nederste række repræsenter -
 Insekter i frysende områder har et protein, der fungerer som frostvæskeFrostvæskeproteiner er en unik klasse af proteiner, hvis virkemekanisme ikke er forstået. Dette kunstneriske indtryk viser brugen af sum-frekvensgenereringsspektroskopi til at bestemme proteinernes
Insekter i frysende områder har et protein, der fungerer som frostvæskeFrostvæskeproteiner er en unik klasse af proteiner, hvis virkemekanisme ikke er forstået. Dette kunstneriske indtryk viser brugen af sum-frekvensgenereringsspektroskopi til at bestemme proteinernes -
 Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive
Ikke-invasiv mikroskopi detekterer aktiveringstilstand og skelner mellem celletyperMetoder til at udtrække funktioner fra mærkefri immuncelleanalyse. Multivariat etiketfri data, sammensat af både morfologiske og spektrale parametre, bruges til at identificere funktioner på højt nive -
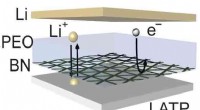 Ny teknik producerer længerevarende lithiumbatterierEn kunstig bornitrid (BN) film er kemisk og mekanisk robust over for lithium. Den isolerer elektronisk lithium aluminium titanium phosphat (LATP) fra lithium, men giver stadig stabile ioniske veje, nå
Ny teknik producerer længerevarende lithiumbatterierEn kunstig bornitrid (BN) film er kemisk og mekanisk robust over for lithium. Den isolerer elektronisk lithium aluminium titanium phosphat (LATP) fra lithium, men giver stadig stabile ioniske veje, nå


