Forklar dannelsen af en ionisk forbindelse sammensat cæsium og fosfor?
1. Identificering af gebyrerne:
* cesium (CS): Cesium er et alkalimetal placeret i gruppe 1 i den periodiske tabel. Det har en tendens til at miste en elektron for at opnå en stabil elektronkonfiguration. Dette resulterer i en +1 ladning, der danner cæsiumkation (CS⁺).
* fosfor (p): Fosfor er en ikke -metal placeret i gruppe 15 i den periodiske tabel. Det har en tendens til at få tre elektroner for at opnå en stabil elektronkonfiguration. Dette resulterer i en -3 -ladning, der danner phosphid -anionen (P³⁻).
2. Afbalancering af gebyrerne:
For at danne en neutral ionisk forbindelse skal den samlede positive ladning svare til den samlede negative ladning. Da cesium har en +1 ladning og fosfor har en -3 -ladning, har vi brug for tre cæsiumioner for hver phosphidion:
* 3 (cs⁺) + 1 (p³⁻) =0
3. Dannelse af forbindelsen:
De positivt ladede cesiumioner (CS⁺) tiltrækkes af de negativt ladede phosphidioner (P³⁻) gennem elektrostatiske kræfter. Denne stærke attraktion danner en ionisk binding, hvilket resulterer i den ioniske forbindelse cesiumphosphid (CS₃P) .
4. Krystalgitterstruktur:
CS₃P -forbindelsen findes som en krystalgitter. Cesiumionerne og phosphidionerne arrangerer sig selv i et specifikt tredimensionelt mønster for at maksimere elektrostatiske attraktioner og minimere afvisninger.
Kortfattet:
Dannelsen af cesiumphosphid (CS₃P) involverer overførsel af elektroner fra cesiumatomer til phosphoratomer, hvilket resulterer i dannelse af positivt ladede cæsiumioner (CS⁺) og negativt ladede phosphidioner (P³⁻). Disse ioner arrangerer derefter sig i et krystalgitter, der holdes sammen af stærke elektrostatiske attraktioner.
Sidste artikelIndeholder den funktionelle gruppe hydroxyl nitrogen?
Næste artikelHvad er de fysiske egenskaber ved klor?
 Varme artikler
Varme artikler
-
 Forskere simulerer dynamiske bilemissioner ved hjælp af guldnanopartikler til katalyseTre forskellige 3D-repræsentationer af terningformede guldnanopartikler, når de oxiderer kulilte. Dataene viser, at belastningen for det meste forekommer i hjørner og kanter. Kredit:Aline Passos og Fl
Forskere simulerer dynamiske bilemissioner ved hjælp af guldnanopartikler til katalyseTre forskellige 3D-repræsentationer af terningformede guldnanopartikler, når de oxiderer kulilte. Dataene viser, at belastningen for det meste forekommer i hjørner og kanter. Kredit:Aline Passos og Fl -
 Forskere udvikler vandtrykssensor, der kan udskrives påI tør tilstand (til venstre; her i en vandfri væske) er sensormaterialet lilla, i våd tilstand (f.eks. fra luftfugtighed) bliver den blå. De trykte emner vist her er hver cirka en centimeter brede. Kr
Forskere udvikler vandtrykssensor, der kan udskrives påI tør tilstand (til venstre; her i en vandfri væske) er sensormaterialet lilla, i våd tilstand (f.eks. fra luftfugtighed) bliver den blå. De trykte emner vist her er hver cirka en centimeter brede. Kr -
 Et nærmere kig på tredjehåndsrygning og dens risiciVed at bruge state-of-the-art teknikker har forskere opnået en bedre forståelse af den komplekse blanding af farlige kemikalier i tredjehåndsrygning - den resterende forurening fra cigaretrygning - so
Et nærmere kig på tredjehåndsrygning og dens risiciVed at bruge state-of-the-art teknikker har forskere opnået en bedre forståelse af den komplekse blanding af farlige kemikalier i tredjehåndsrygning - den resterende forurening fra cigaretrygning - so -
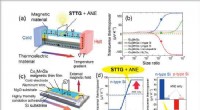 Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s


