Hvad vil et calciumatomform ionisk eller kovalent binding?
* Metallisk natur: Calcium er et metal placeret i gruppe 2 i den periodiske tabel (alkaliske jordmetaller). Metaller har en tendens til at miste elektroner for at opnå en stabil elektronkonfiguration.
* Elektropositivitet: Calcium har en lav ioniseringsenergi, hvilket betyder, at den let mister sine yderste elektroner. Dette gør det elektropositivt, hvilket betyder, at det har en tendens til at danne positive ioner.
* ikke -metalpartnere: Calcium danner typisk bindinger med ikke -metaller, såsom ilt, klor eller fluor. Ikke -metaller har en høj elektronegativitet og har en tendens til at vinde elektroner.
* Elektrostatisk attraktion: Overførslen af elektroner fra calcium til en ikke -metal skaber modsat ladede ioner. Disse ioner holdes derefter sammen af en stærk elektrostatisk attraktion, der danner en ionisk binding.
Eksempel:
Calcium reagerer med chlor (CL) for at danne calciumchlorid (CACL₂). Calcium mister to elektroner for at blive en ca²⁺ion, mens klor får en elektron for at blive en cl⁻ion. Den elektrostatiske tiltrækning mellem disse ioner danner den ioniske binding.
Sidste artikelHvad er pH -værdien af kaliumsulfat?
Næste artikelHvilken type binding er siliciumtetrafluorid?
 Varme artikler
Varme artikler
-
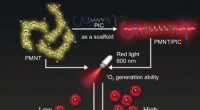 Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi
Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi -
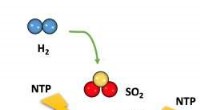 Ny svovldioxidomdannelsesmetode kan ændre nuværende industrielle teknikkerSkematisk illustration af den plasmakatalytiske svovldioxidreduktion med hydrogen eller methan til svovl ved lav temperatur. Kredit:Penn State Et enkelt trin, plasma-forstærket katalytisk proces t
Ny svovldioxidomdannelsesmetode kan ændre nuværende industrielle teknikkerSkematisk illustration af den plasmakatalytiske svovldioxidreduktion med hydrogen eller methan til svovl ved lav temperatur. Kredit:Penn State Et enkelt trin, plasma-forstærket katalytisk proces t -
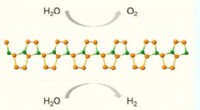 Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me
Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me -
 Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi
Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi
- Hydrogelbaserede elektroder til hjerneimplantater udviklet
- Hvad sker der med din krypto, hvis du dør?
- Formål med at tilføje NaOH til blandingen, før de tager polarimeterlæsning?
- Lyse galaktiske røntgenkerner
- Små mikroplastik slipper ikke længere gennem sprækkerne med en ny metode til påvisning
- Hvad er nogle eksempler på lang rækkevidde?


