Hvad er forskellen og lighederne for brint i gruppe 1 17?
Ligheder:
* Elektronkonfiguration: Hydrogen har kun et elektron i sin ydre skal, svarende til alkalimetaller (gruppe 1). Det har også en tendens til at miste dette elektron for at opnå en stabil ædelgaskonfiguration som gruppe 1 -elementer.
* Dannelse af kationer: Hydrogen kan danne en positiv ion (H+), svarende til alkalimetaller, især i sure opløsninger.
* reaktivitet: Ligesom halogener (gruppe 17) er brint meget reaktiv og danner let forbindelser med mange andre elementer.
Forskelle:
* Metallisk karakter: Hydrogen er et ikke-metal, i modsætning til alkalimetaller, som alle er metaller.
* Fysiske egenskaber: Brint findes som en farveløs, lugtfri gas ved stuetemperatur, i modsætning til alkalimetaller, som er faste ved stuetemperatur.
* Elektronaffinitet: Hydrogen har en meget lavere elektronaffinitet end halogener. Dette betyder, at det er mindre sandsynligt, at det får en elektron og danner en negativ ion (H-) sammenlignet med halogener, der let danner anioner.
* Gruppeplacering: Hydrogen er typisk placeret over gruppe 1 i den periodiske tabel, hvilket afspejler dens tendens til at miste et elektron. Imidlertid er det også undertiden placeret over gruppe 17 på grund af dens reaktivitet og evne til at danne forbindelser, der ligner halogener.
Kortfattet:
* Hydrogen deler ligheder med både gruppe 1 og gruppe 17, men passer ikke perfekt ind i nogen af grupperne på grund af dets unikke egenskaber. Det er et specielt element med en kombination af egenskaber fra begge familier.
* dens placering i den periodiske tabel er noget tvetydig og et spørgsmål om debat. Det betragtes ofte som et unikt element, der ikke fuldt ud hører til nogen specifik gruppe.
Fortæl mig, hvis du gerne vil gå dybere ned i et specifikt aspekt!
Sidste artikelHvad er antallet af elektroner i et kloratom?
Næste artikelHvilken har højere dissocieringskonstant NaCl eller CH3Coona?
 Varme artikler
Varme artikler
-
 Vurdering af begyndelsen af calciumphosphatkernen ved hyperpolariseret real-time NMRFor at skabe effektive funktionelle materialer, naturen tilbyder de bedste opskrifter ved at levere evolutionært vellykkede koncepter, siger Dennis Kurzbach fra Institut for Biologisk Kemi. Kredit:© S
Vurdering af begyndelsen af calciumphosphatkernen ved hyperpolariseret real-time NMRFor at skabe effektive funktionelle materialer, naturen tilbyder de bedste opskrifter ved at levere evolutionært vellykkede koncepter, siger Dennis Kurzbach fra Institut for Biologisk Kemi. Kredit:© S -
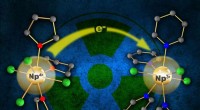 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
 Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd
Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd -
 Prøveforberedelse i retsmedicinsk toksikologisk analyse kan have enorme konsekvenserKredit:CC0 Public Domain Når analytisk instrumentering (gas- og væskekromatografer kombineret med massespektrometre) øges i følsomhed og hastighed, retsmedicinere kan stadig finde sig selv forhind
Prøveforberedelse i retsmedicinsk toksikologisk analyse kan have enorme konsekvenserKredit:CC0 Public Domain Når analytisk instrumentering (gas- og væskekromatografer kombineret med massespektrometre) øges i følsomhed og hastighed, retsmedicinere kan stadig finde sig selv forhind
- Hvad er ukrudtspredning?
- Hvilken naturlig ressource blev fundet omkring Sinai -halvøen?
- Er dicarbon dihydrid et flydende fast stof eller gas?
- Ny fotokatalysator øger vandspaltningseffektiviteten til ren brintproduktion
- Hvad er produkterne fra neutraliseringsreaktion mellem NHO3 og CA (OH) 2?
- Hvordan adskiller Ferromagnesian mineraler sig fra andre stendannende mineraler?


