Hvad er orbitalnotationen af svovl?
Svovls elektroniske konfiguration:
* atomnummer: 16 (hvilket betyder, at det har 16 protoner og 16 elektroner)
* Elektronisk konfiguration: 1S² 2S² 2P⁶ 3S² 3P⁴
Orbital Notation:
* 1s: ↑ ↓ (2 elektroner)
* 2s: ↑ ↓ (2 elektroner)
* 2p: ↑ ↓ ↑ ↓ ↑ (6 elektroner)
* 3s: ↑ ↓ (2 elektroner)
* 3p: ↑ ↓ ↑ (4 elektroner)
Forklaring:
* orbitaler: Elektroner besætter specifikke områder af plads omkring kernen kaldet orbitaler. Vi bruger det principielle kvantetal (N) til at indikere energiniveauet (1, 2, 3 osv.) Og bogstaver (S, P, D, F) til at repræsentere orbitalformerne.
* s orbitaler: Hver s orbital kan maksimalt indeholde 2 elektroner.
* p orbitaler: Hver P -underskal har tre orbitaler (PX, PY, PZ), der hver er i stand til at holde 2 elektroner.
* Hunds regel: Elektroner fyldes individuelt hver orbital inden for et underskal, før de parrer sig.
* Pauli Ekskluderingsprincip: Hver orbital kan maksimalt indeholde 2 elektroner, og de skal have modsatte spins (repræsenteret ved pile, der peger op og ned).
Nøglepunkter:
* Svovl har 6 valenselektroner (elektroner i den yderste skal).
* Disse valenselektroner bestemmer svovls kemiske opførsel.
* Orbitalnotationen hjælper med at visualisere, hvordan elektronerne distribueres i atomet.
Fortæl mig, hvis du har yderligere spørgsmål!
 Varme artikler
Varme artikler
-
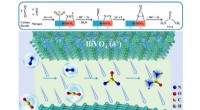 Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge
Nye katalysatorer forbedrer effektiviteten af urinstofsyntese ved omgivende betingelserDen skematiske elektrokatalytiske ureasyntesemekanisme baseret på Bi-BiVO 4 Mott-Schottky heterostruktur synergistiske effekter Kredit:Zhang Guangjin og Yuan Menglei Konvertering af både nitroge -
 Visualisering af stress i plastDet udviklede farvestof viser stress af forskellig størrelse i plastkomponenter. Hvorvidt dette virker, blev undersøgt ved hjælp af mekaniske eksperimenter på testprøver indeholdende farvestoffet. Kre
Visualisering af stress i plastDet udviklede farvestof viser stress af forskellig størrelse i plastkomponenter. Hvorvidt dette virker, blev undersøgt ved hjælp af mekaniske eksperimenter på testprøver indeholdende farvestoffet. Kre -
 Forskere tager et vigtigt skridt mod gonorévaccineKredit:CDC Forskere baner vejen mod en ny terapeutisk tilgang til gonoré ved at kaste lys over mekanismen bag vigtige proteiner på Neisseria gonorrhoeae-bakteriens ydre membran. Fremtidige terapi
Forskere tager et vigtigt skridt mod gonorévaccineKredit:CDC Forskere baner vejen mod en ny terapeutisk tilgang til gonoré ved at kaste lys over mekanismen bag vigtige proteiner på Neisseria gonorrhoeae-bakteriens ydre membran. Fremtidige terapi -
 Brændstofaerosoler reducerer forurening af miljøetKredit:Tomsk Polytechnic University (TPU) En ressourceeffektiv teknologi til produktion af brændstofaerosoler er blevet udviklet ved Tomsk Polytechnic University. Udviklingen kan bruges til hurtig
Brændstofaerosoler reducerer forurening af miljøetKredit:Tomsk Polytechnic University (TPU) En ressourceeffektiv teknologi til produktion af brændstofaerosoler er blevet udviklet ved Tomsk Polytechnic University. Udviklingen kan bruges til hurtig


