Hvor mange milliliter af en 6,00 m opløsning af saltsyre er nødvendige for at reagere fuldstændigt med 45,5 g zinksulfid i henhold til den kemiske reaktion vist nedenfor?
1. Skriv den afbalancerede kemiske ligning:
Zns (S) + 2HCl (aq) → Zncl₂ (aq) + H₂s (g)
2. Beregn molen af zinksulfid:
* Molmasse af Zns =65,38 g/mol (Zn) + 32,06 g/mol (s) =97,44 g/mol
* Mol Zns =masse / molmasse =45,5 g / 97,44 g / mol =0,467 mol
3. Bestem de nødvendige mol på HCL:
* Fra den afbalancerede ligning reagerer 1 mol ZnS med 2 mol HCI.
* Mol HCl =0,467 mol Zns * (2 mol HCI
4. Beregn mængden af HCL -løsning:
* Molaritet (M) =mol opløst / volumen af opløsning (i liter)
* Volumen af HCL -opløsning =mol HCI / molaritet =0,934 mol / 6,00 m =0,156 L
5. Konverter liter til milliliter:
* Volumen af HCL -opløsning =0,156 L * 1000 ml/l =156 ml
Derfor har du brug for 156 ml af en 6,00 m saltsyreopløsning for at reagere fuldstændigt med 45,5 g zinksulfid.
Sidste artikelHvordan adskiller du ammoniumchlorid og svovl fra dets blanding?
Næste artikelHvilke stoffer er til stede i jordens atmosfære?
 Varme artikler
Varme artikler
-
 Højtydende stort arealelektrodesystem udviklet til kunstig fotosyntese(Til højre) Nano-katalysatorelektrode i koralform med høj ydeevne, stort område udviklet af KIST-forskere (elektrode størrelse 50 cm) (venstre) Katalysatorelektrode til syntetisk fotosyntese i eksiste
Højtydende stort arealelektrodesystem udviklet til kunstig fotosyntese(Til højre) Nano-katalysatorelektrode i koralform med høj ydeevne, stort område udviklet af KIST-forskere (elektrode størrelse 50 cm) (venstre) Katalysatorelektrode til syntetisk fotosyntese i eksiste -
 Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved
Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved -
 Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god -
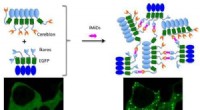 Se små molekylers interaktioner inde i cellerKredit:American Chemical Society Som mennesker i en stor virksomhed, proteiner i celler interagerer konstant med hinanden for at udføre forskellige job. At udvikle nye sygdomsbehandlinger, forsker
Se små molekylers interaktioner inde i cellerKredit:American Chemical Society Som mennesker i en stor virksomhed, proteiner i celler interagerer konstant med hinanden for at udføre forskellige job. At udvikle nye sygdomsbehandlinger, forsker
- Forskere viser, at voksende atomtynde plader på kegler tillader kontrol af defekter
- Hvor mange replikationsgafler produceres, når DNA -denaturer med en oprindelse?
- Er regnskove og jungler den samme ting?
- Hvad er den øverste mantel af jord lavet af?
- Hvad ser vi på himlen, når det er en første quorter -måne?
- Hvordan man laver et Ocean Project ud af en Shoebox


