Hvor mange elektroner forstærker en svovlatom, når det bliver en sulfidion?
Her er hvorfor:
* Svovls naturlige tilstand: Svovl har 16 elektroner i sin neutrale tilstand.
* Svovls elektronkonfiguration: Elektronkonfigurationen af svovl er 2-8-6. Dette betyder, at det har 6 elektroner i sin yderste skal (Valence Shell).
* octet regel: Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil oktet (8 elektroner) i deres yderste skal.
* sulfidiondannelse: Svovl får to elektroner for at opnå en fuld oktet (2-8-8) og bliver en sulfidion (S²⁻).
 Varme artikler
Varme artikler
-
 Forskere skal undersøge, om metalkorroderende mikrober kan vokse i Canadas foreslåede atomaffaldsa…Kredit:Pixabay/CC0 Public Domain Med Canada tættere på at flytte alt sit brugte nukleare brændsel til en enkelt facilitet og indkapsle hver brændstofbeholder i bentonit-ler, studerer forskere, om d
Forskere skal undersøge, om metalkorroderende mikrober kan vokse i Canadas foreslåede atomaffaldsa…Kredit:Pixabay/CC0 Public Domain Med Canada tættere på at flytte alt sit brugte nukleare brændsel til en enkelt facilitet og indkapsle hver brændstofbeholder i bentonit-ler, studerer forskere, om d -
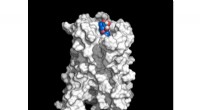 Seneste fund om bitterstoffer i kaffeModel af den bitre receptor TAS2R43 uden ekstracellulært domæne. I bindingslommen:Model af bitterstoffet mozambiosid (blå). Kredit:Leibniz-LSB@TUM; Dr. Antonella Di Pizio Kaffe er meget populær ov
Seneste fund om bitterstoffer i kaffeModel af den bitre receptor TAS2R43 uden ekstracellulært domæne. I bindingslommen:Model af bitterstoffet mozambiosid (blå). Kredit:Leibniz-LSB@TUM; Dr. Antonella Di Pizio Kaffe er meget populær ov -
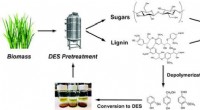 Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan -
 Ny NIST-forskning kan nedbringe omkostningerne ved at lave nikkelNår du designer en ny mønt, Amerikanske regeringsorganer som NIST bruger et dummy-aftryk for ikke at løbe på kant med reglerne mod varemærkeforfalskning. Her, Martha Washington i en pøbelkasket træder
Ny NIST-forskning kan nedbringe omkostningerne ved at lave nikkelNår du designer en ny mønt, Amerikanske regeringsorganer som NIST bruger et dummy-aftryk for ikke at løbe på kant med reglerne mod varemærkeforfalskning. Her, Martha Washington i en pøbelkasket træder


