Hvad binder Cesium med?
Ikke-metaler:
* halogener: Cesium danner let ioniske bindinger med halogener (fluor, chlor, brom, jod og astatin) for at skabe salte som CSF (Cesiumfluorid), CSCL (cesiumchlorid), CSBR (cesiumbromid), CSI (cesiumi iodid).
* ilt: Cesium danner oxid CS₂O (cesiumoxid) og andre oxider som CS₂O₂ og CSO₂.
* svovl: Cesium kan danne sulfider som CS₂S (cæsiumsulfid).
* nitrogen: Cesium kan danne nitrider som CS₃N (cesiumnitrid).
* fosfor: Cesium kan danne phosphider som CS₃P (cesiumphosphid).
Andre metaller:
* Intermetalliske forbindelser: Cesium kan danne intermetalliske forbindelser med andre metaller, som legeringer med guld, kviksølv og andre alkalimetaller.
Andre overvejelser:
* reaktivitet: Cesium er det mest reaktive alkalimetal, hvilket betyder, at det reagerer kraftigt med vand og eksploderer endda, når den udsættes for luft. Dette gør håndtering af det ekstremt farligt og kræver specialiserede procedurer.
* ioniske bindinger: Cesium danner overvejende ioniske bindinger, hvor det let donerer sit elektron til at danne en positiv ion og interagerer elektrostatisk med en negativt ladet ion.
* kovalente obligationer: Selvom det er mindre almindeligt, kan cæsium deltage i kovalent binding med nogle ikke-metaller under specifikke forhold.
anvendelser:
Cæsiumens høje reaktivitet begrænser dens praktiske anvendelser. Den finder dog brug i:
* atomur: Caesium-133 er standarden for at definere det andet i atomur på grund af dens stabile og præcise atomovergange.
* forskning: Cesium bruges i forskellige forskningsapplikationer på grund af dets unikke egenskaber.
Kortfattet: Cesiumbindinger binder primært med ikke-metaler gennem ioniske interaktioner for at danne salte og oxider. Det kan også danne intermetalliske forbindelser med andre metaller. På grund af sin høje reaktivitet kræver Cesium specialiseret håndtering og bruges primært i videnskabelige og forskningsapplikationer.
Sidste artikelHvad er sammensætningen af organiske forbindelser?
Næste artikelHvor går et opløst fast stof?
 Varme artikler
Varme artikler
-
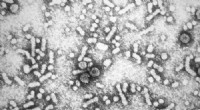 Forskere bruger supercomputer til at få indsigt i hepatitis BElektronmikroskopi af hepatitis B-virus. Kredit:Centers for Disease Control and Prevention Forskere ved University of Delaware, ved hjælp af supercomputeressourcer og samarbejde med forskere ved I
Forskere bruger supercomputer til at få indsigt i hepatitis BElektronmikroskopi af hepatitis B-virus. Kredit:Centers for Disease Control and Prevention Forskere ved University of Delaware, ved hjælp af supercomputeressourcer og samarbejde med forskere ved I -
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
 Web-baseret open source-program bestemmer proteinstrukturerStefan Arold (th.) og hans team spiller en afgørende rolle i det lokale videnskabelige samfund gennem samarbejde med andre forskningsgrupper i Kongeriget. Kredit:KAUST ContaMiner er en webbaseret,
Web-baseret open source-program bestemmer proteinstrukturerStefan Arold (th.) og hans team spiller en afgørende rolle i det lokale videnskabelige samfund gennem samarbejde med andre forskningsgrupper i Kongeriget. Kredit:KAUST ContaMiner er en webbaseret, -
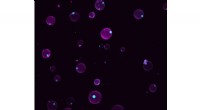 Kunstige celler reagerer på miljøændringerSyntetiske celler med rum. Magenta viser lipidmembranen, cyan viser de fluorescensmærkede membranfrie underrum. Kredit:MPI-CBG/ Love et al. Celler er den grundlæggende enhed i livet. De giver et m
Kunstige celler reagerer på miljøændringerSyntetiske celler med rum. Magenta viser lipidmembranen, cyan viser de fluorescensmærkede membranfrie underrum. Kredit:MPI-CBG/ Love et al. Celler er den grundlæggende enhed i livet. De giver et m
- Hvad hedder Compound Mn2 SO43?
- Hvad er funktionen af ethylen?
- Hvordan bøjes lys, når det går ind i et tættere materiale?
- Hvordan partikler pakker sig i et begrænset rum
- Hvilken grøft inden for ildringen ligger længst nord?
- Hvad er almindelige genstande, der er designet til at fungere som isolatorer?


