Hvad sker der, når en syre reagerer med et metal?
Her er en sammenbrud:
reaktionen:
* syre + metal → salt + brintgas
Eksempel:
* saltsyre (HCI) + zink (Zn) → zinkchlorid (ZnCl2) + hydrogengas (H2)
Forklaring:
1. hydrogenioner (H+) fra syren: Syrer indeholder hydrogenioner (H+), der er ansvarlige for deres sure egenskaber.
2. metalatomer: Metaller har en tendens til at miste elektroner og danne positivt ladede ioner.
3. reaktion: Hydrogenionerne fra syren reagerer med metalatomerne, hvilket får metallet til at miste elektroner og danne positivt ladede ioner.
4. saltdannelse: De positivt ladede metalioner kombineres med de negativt ladede ioner (anioner) fra syren for at danne et salt.
5. brintgasfrigivelse: Hydrogenionerne (H+) får elektroner fra metalatomerne og kombineres for at danne brintgas (H2), der frigøres som bobler.
Vigtige noter:
* Ikke alle metaller reagerer med syrer: Nogle metaller, som guld og platin, er ureaktive med almindelige syrer.
* reaktivitetsserie: Reaktiviteten af forskellige metaller med syrer varierer. Metaller, der er højere i reaktivitetsserien, er mere tilbøjelige til at reagere.
* Korrosion: Reaktionen af syrer med metaller kan bidrage til korrosion, den gradvise slidning af metallet.
Praktiske applikationer:
* Produktion af brintgas: Reaktionen af syrer med metaller bruges til at producere brintgas i laboratorier og industrielle processer.
* metalrensning: Syrer bruges til at rengøre metaloverflader ved at fjerne urenheder.
* Korrosionsforebyggelse: At forstå reaktionen af syrer med metaller er afgørende for at forhindre korrosion i forskellige anvendelser.
Sidste artikelCarbon kan reagere på hvor mange atomer på én gang?
Næste artikelEt siliciumatomer for hver to oxyen -kemiske formler?
 Varme artikler
Varme artikler
-
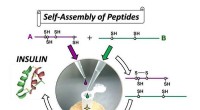 Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in -
 Ny forskning skaber en neutraliserende svamp til farlige kemikalierKredit:Pixabay/CC0 Public Domain Dr. Simon Holder, Læser i organisk kemi ved University of Kent (UK) og Dr. Barry Blight, lektor i kemi ved University of New Brunswick (Canada), har udviklet en ny
Ny forskning skaber en neutraliserende svamp til farlige kemikalierKredit:Pixabay/CC0 Public Domain Dr. Simon Holder, Læser i organisk kemi ved University of Kent (UK) og Dr. Barry Blight, lektor i kemi ved University of New Brunswick (Canada), har udviklet en ny -
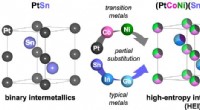 Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis
Carbonneutraliserende propylenproduktion katalyserer ændringer i petrokemisk teknikPlatin (Pt) og tin (Sn) steder i intermetallisk PtSn er delvist substitueret med henholdsvis Cobalt og nikkel (Co/Ni) og Indium og Gallium (In/Ga), hvilket danner en PtSn-type højentropi intermetallis -
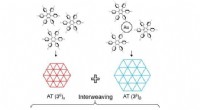 Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat
Meget kompleks todimensionel tessellation i den molekylære verdenFigur viser tre typer af meget komplekse sammenvævede tesselleringer baseret på to forskellige molekylære faser konstrueret af en enkelt molekylær byggesten. Kredit:Nature Communications Tessellat
- Hvorfor den eutektiske blanding ikke er en forbindelse?
- Hvilket lag af jorden indeholder klippemineraler og jord?
- NASA udvælger forslag til at demonstrere smallSat-teknologier til at studere interplanetarisk rum
- Første storstilede undersøgelse belyser kunstnerens mangfoldighed på amerikanske museer
- Typer af meteorologi
- Mac -softwaretrusler steg 400% i 2019, mere end Microsoft Windows, siger rapporten


