Er carbonforbindelser dannet ved at udveksle elektroner med kulstof?
Her er en sammenbrud:
* Carbon's bindingsadfærd: Carbon har fire valenselektroner, hvilket betyder, at det kan danne fire bindinger med andre atomer. Det opnår stabilitet ved at danne kovalente bindinger, hvor det deler elektroner med andre atomer.
* kovalent binding: I kovalente bindinger deler atomer elektroner for at fylde deres ydre skal og opnå en stabil konfiguration. Denne deling, ikke en komplet udveksling, skaber den stærke binding, der holder kulstofforbindelser sammen.
* Carbon's alsidighed: Carbons evne til at danne fire bindinger med forskellige andre elementer (brint, ilt, nitrogen osv.) Bidrager til den enorme mangfoldighed af kulstofforbindelser. Disse forbindelser kan være enkle som metan (CH4) eller utroligt komplekse som proteiner og DNA.
Kortfattet: Kulstofforbindelser dannes af Carbon's evne til at dele elektroner med andre atomer gennem kovalente bindinger. Denne deling af elektroner fører til en lang række forbindelser med forskellige strukturer og egenskaber.
Sidste artikelHvor mange atomer er der i 16,3 gram svovl?
Næste artikelHvordan afslutter carbonatomet sin oktet?
 Varme artikler
Varme artikler
-
 Ved at tilføje belastning, forskere forbedrer metallisk glasFig. 1:Eksperimentel realisering af exciteret væskekøling. Kredit: Kommunikationsmaterialer (2021). DOI:10.1038/s43246-021-00127-0 Metalliske glas - materialer med metalstyrke, men formbare som p
Ved at tilføje belastning, forskere forbedrer metallisk glasFig. 1:Eksperimentel realisering af exciteret væskekøling. Kredit: Kommunikationsmaterialer (2021). DOI:10.1038/s43246-021-00127-0 Metalliske glas - materialer med metalstyrke, men formbare som p -
 Kan defekter gøre inaktive materialer til nyttige, aktive?Defekter i gitterstrukturen af hexagonalt bornitrid kan påvises med fotoluminescens. Forskere skinner et lys med en farve eller energi på materialet og får en anden farve fra defekten. Derudover vis
Kan defekter gøre inaktive materialer til nyttige, aktive?Defekter i gitterstrukturen af hexagonalt bornitrid kan påvises med fotoluminescens. Forskere skinner et lys med en farve eller energi på materialet og får en anden farve fra defekten. Derudover vis -
 Video:Brændende is fra havbundenKredit:The American Chemical Society Methanhydrat er et krystallinsk kompleks af vand og metan, der dannes under havbunden. Det ligner almindelig is, men det kan nemt sættes i brand, når det er br
Video:Brændende is fra havbundenKredit:The American Chemical Society Methanhydrat er et krystallinsk kompleks af vand og metan, der dannes under havbunden. Det ligner almindelig is, men det kan nemt sættes i brand, når det er br -
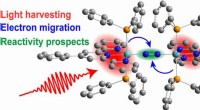 Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste
Hvordan sollys giver elektroner energi til at bryde nitrogen og danne ammoniakDen skematiske tegning viser den potentielle aktivering af et nitrogenmolekyle (blå kugler), der er holdt i midten af katalysatoren. Lys høstes (rødt), og elektroner migrerer (blå pile) for i sidste
- Hvordan bruger du sedimentær klippe i en sætning?
- Sådan fungerer bæredygtigt skovbrug
- Hvor meget energidosis kulkraft producerer?
- Sover edderkopper? Undersøgelse tyder på, at de kan slumre som mennesker
- Kildeposition og varighed af et solcelletype III radioudbrud observeret af LOFAR
- Hvilken erklæring beskriver bedst den metode, der bruges til at indsamle videnskabelige data?


