Hvorfor klassificeres benzen som en aromatisk forbindelse?
1. Cyklisk struktur: Benzen har en lukket ring med seks carbonatomer, der danner en cyklisk struktur.
2. Plangeometri: De seks carbonatomer i benzen ligger i det samme plan, hvilket giver det en flad struktur.
3. Delokaliserede elektroner: Hvert carbonatom i benzen er sp 2 hybridiseret, efterlader en uhybridiseret P orbital. Disse P -orbitaler overlapper hinanden over og under planet i ringen og danner et kontinuerligt system med delokaliserede PI -elektroner.
4. Huckels regel: Benzen tilfredsstiller Huckels regel, der siger, at et cyklisk, plant molekyle med en kontinuerlig ring af delokaliserede elektroner vil være aromatisk, hvis den har 4N+2 PI -elektroner. Benzen har 6 PI -elektroner (4 (1) +2), der opfylder denne tilstand.
5. Forbedret stabilitet: På grund af delokaliseringen af elektroner deles elektronerne lige blandt alle carbonatomer i ringen. Denne elektron -delokalisering stabiliserer markant molekylet sammenlignet med en hypotetisk cyclohexatrienstruktur med isolerede dobbeltbindinger. Denne stabilitet er tydelig i den relativt lave varme af hydrogenering sammenlignet med cyclohexen.
6. Aromatiske egenskaber: Benzen udviser egenskaber, der er karakteristiske for aromatiske forbindelser, såsom:
* Modstand mod tilsætningreaktioner, der favoriserer elektrofile aromatiske substitutionsreaktioner.
* Lavere reaktivitet sammenlignet med alkener.
* Stabilitet og en markant aroma.
I resumé gør den cykliske struktur, plane geometri, delokaliserede PI -elektroner og overholdelse af Huckels regel benzen til et godt eksempel på en aromatisk forbindelse. Dens unikke elektroniske struktur bidrager til dens usædvanlige stabilitet og karakteristiske kemiske opførsel.
Sidste artikelHvad er Mohs -hårdhed af is?
Næste artikelHvor mange elektroner skal natrium miste, før det har en oktet?
 Varme artikler
Varme artikler
-
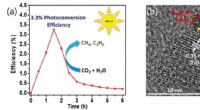 En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat
En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat -
 Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe
Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe -
 CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be
CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be -
 Kemikere tester Chematicas evne til at generere syntetiske ruterEt team af kemikere, der arbejder for MilliporeSigma, et firma, der købte Chematica, et computerprogram, der genererer syntetiske ruter (den række reaktioner, der er nødvendige for at skabe et synteti
Kemikere tester Chematicas evne til at generere syntetiske ruterEt team af kemikere, der arbejder for MilliporeSigma, et firma, der købte Chematica, et computerprogram, der genererer syntetiske ruter (den række reaktioner, der er nødvendige for at skabe et synteti
- Hvordan kalder du ændringen af fasevæske til gas?
- På jagt efter mørkt stof i de mindste galakser i universet
- Hvorfor kul dannes i Arktis?
- Nanoteknik forbedrer ladningstransporten, lover mere effektive fremtidige solceller
- Hvad er kaldenavnet på Nordpolen?
- Er det sandt eller falskt, at videnskabelige metoder har to grundlæggende typer?


