Hvad er elektronpargeometrien til et hydrogensulfidmolekyle?
Her er hvorfor:
* Centralatom: Svovl (er) er det centrale atom.
* Valenselektroner: Svovl har 6 valenselektroner, og hvert brint har 1.
* binding: Svovl danner to enkeltbindinger med de to hydrogenatomer ved hjælp af to af dets valenselektroner.
* Ensomme par: Svovl har to resterende valenselektroner, der danner et ensomt par.
* Elektronpar Geometri: I henhold til VSEPR -teorien vil de fire elektronpar (to bindingspar og to ensomme par) omkring svovlatomet arrangere sig i en tetrahedral form for at minimere frastødning.
Vigtig note: Mens elektronpargeometrien er tetrahedral, molekylær geometri af H₂s er bøjet eller vinkel . Dette skyldes, at de ensomme par på svovl afviser bindingsparene, hvilket får H-S-H-bindingsvinklen til at være mindre end 109,5 grader.
Sidste artikelHvorfor påvirker overfladearealet af en reaktant hastighedsreaktionen?
Næste artikelHvad bruges ilt til, og hvorfor?
 Varme artikler
Varme artikler
-
 Producerer proteinbatterier for sikrere, miljøvenlig strømopbevaringKredit:CC0 Public Domain Proteiner er gode til at opbygge muskler, men deres byggeklodser kan også være nyttige til at bygge bæredygtige økologiske batterier, der en dag kan være en levedygtig ers
Producerer proteinbatterier for sikrere, miljøvenlig strømopbevaringKredit:CC0 Public Domain Proteiner er gode til at opbygge muskler, men deres byggeklodser kan også være nyttige til at bygge bæredygtige økologiske batterier, der en dag kan være en levedygtig ers -
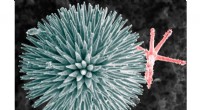 Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud
Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud -
 At omdanne menneskeligt affald til plastik, næringsstoffer kan hjælpe med lange rumrejserAstronauter kunne en dag drage fordel af at genbruge menneskeligt affald på lange rumrejser (fotoillustration). Kredit:American Chemical Society Forestil dig, at du er på vej til Mars, og du miste
At omdanne menneskeligt affald til plastik, næringsstoffer kan hjælpe med lange rumrejserAstronauter kunne en dag drage fordel af at genbruge menneskeligt affald på lange rumrejser (fotoillustration). Kredit:American Chemical Society Forestil dig, at du er på vej til Mars, og du miste -
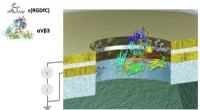 Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at
Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at


