Ved STP -fluor er et gas- og jodstof, denne observation kan forklares med det faktum, at det har?
Her er hvorfor:
* atomradius: Jod er meget større end fluor. Dette betyder, at elektronerne i jod er længere væk fra kernen og oplever svagere tiltrækning, hvilket gør molekylet lettere at polarisere.
* Intermolekylære kræfter: Fluor findes som et diatomisk molekyle (F2) og holdes sammen af svage London -spredningskræfter. Jod (I2) har stærkere London -spredningskræfter på grund af dens større størrelse og større polariserbarhed. Derudover kan jod danne midlertidige dipol-dipol-interaktioner, hvilket yderligere bidrager til dens stærkere intermolekylære kræfter.
Disse stærkere kræfter i jod kræver mere energi til at overvinde, hvilket resulterer i et højere smeltepunkt og dermed dens solide tilstand ved STP. Fluor med sine svagere kræfter har et lavere smeltepunkt og findes som en gas ved STP.
 Varme artikler
Varme artikler
-
 Bioinspirerede molekylære farvestoffer til biomedicinsk fluorescerende billeddannelseLong Stokes skifter SOD til biomedicinsk fluorescensbilleddannelse. (A) Kemisk struktur, molekylvægt, maksimal absorption og emissionsbølgelængde, Stokes skift af typiske kommercielle fluorescerende f
Bioinspirerede molekylære farvestoffer til biomedicinsk fluorescerende billeddannelseLong Stokes skifter SOD til biomedicinsk fluorescensbilleddannelse. (A) Kemisk struktur, molekylvægt, maksimal absorption og emissionsbølgelængde, Stokes skift af typiske kommercielle fluorescerende f -
 Forskere gør plastflaskeaffald til ultralet supermateriale med vidtrækkende applikationerEt team ledet af forskere fra National University of Singapore har fundet en måde at forvandle plastflaskeaffald til ultralette polyethylenterephthalat (PET) aerogeler, der er velegnede til forskellig
Forskere gør plastflaskeaffald til ultralet supermateriale med vidtrækkende applikationerEt team ledet af forskere fra National University of Singapore har fundet en måde at forvandle plastflaskeaffald til ultralette polyethylenterephthalat (PET) aerogeler, der er velegnede til forskellig -
 Fokus på atomaffaldskemi kunne hjælpe føderale udfordringer på oprydningsstedetOak Ridge National Laboratory, Pacific Northwest National Laboratory og Washington State University henvender sig til grundlæggende kemi for at fremme oprydningsstrategier for ældre tankaffald. Afbild
Fokus på atomaffaldskemi kunne hjælpe føderale udfordringer på oprydningsstedetOak Ridge National Laboratory, Pacific Northwest National Laboratory og Washington State University henvender sig til grundlæggende kemi for at fremme oprydningsstrategier for ældre tankaffald. Afbild -
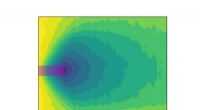 Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af
Nanocylindervibrationer hjælper med at kvantificere polymerhærdning til 3D-printFarvelagt plot af lys-assisteret hærdning af en polymer over fem sekunder, som målt med NISTs brugerdefinerede atomkraftmikroskop med en nanocylindersonde. Mørkere farver indikerer et højere niveau af
- Arranger følgende elementer fra størst til mindste tendens til at acceptere en elektron. Cl S Si M…
- Biologer rapporterer, hvordan hvaler har ændret sig over 35 millioner år
- Var varme, fugtige somre nøglen til livets oprindelse?
- Hvad er 3 naturressourcer, der kommer fra litosfæren?
- Forskere fremmer en måde at spore ændringer i et persons kardiovaskulære system
- Sådan fungerer gyroskopet


