Hvorfor udfører natriumchlorid elektricitet, når den er i flydende form, men ikke fast form?
solid NaCl:
* ionisk struktur: Natriumchlorid er en ionisk forbindelse. Dette betyder, at det består af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) holdt sammen af stærke elektrostatiske kræfter.
* faste positioner: I faste NaCl er disse ioner arrangeret i en stiv, krystallinsk gitterstruktur. De er låst i faste positioner og kan ikke bevæge sig frit.
* Ingen gratis opladningsbærere: Da ionerne er immobile, er der ingen frie afgifter til at bære en elektrisk strøm.
flydende NaCl (smeltet salt):
* Meltning og ionmobilitet: Når NaCl smelter, er de stærke elektrostatiske kræfter, der holder ionerne sammen, svækket. Ionerne slipper fri fra deres faste positioner og bliver mobile.
* Gratis ladningsbærere: Disse mobile ioner kan nu bevæge sig frit. Når et elektrisk potentiale påføres, bevæger de positive natriumioner mod den negative elektrode, og de negative chloridioner bevæger sig mod den positive elektrode.
* Konduktivitet: Denne bevægelse af ladede partikler udgør en elektrisk strøm, hvilket gør smeltet NaCl til en god leder af elektricitet.
Kort sagt:
* Solid NaCl:Faste ioner, ingen frie ladningsbærere, ingen ledningsevne.
* Liquid NaCl:Mobile ioner, gratis ladningsbærere, god ledningsevne.
Sidste artikelHvad hedder en forbindelse lavet af tin og ilt?
Næste artikelEn matrix af fine krystaller omkring fænokryster?
 Varme artikler
Varme artikler
-
 3-D printede dæk og sko, der reparerer sig selvAfskåret 3D-printet skopude reparerer sig selv. Kredit:An Xin og Kunhao Yu I stedet for at smide dine ødelagte støvler eller revnet legetøj væk, hvorfor ikke lade dem ordne sig selv? Forskere ved
3-D printede dæk og sko, der reparerer sig selvAfskåret 3D-printet skopude reparerer sig selv. Kredit:An Xin og Kunhao Yu I stedet for at smide dine ødelagte støvler eller revnet legetøj væk, hvorfor ikke lade dem ordne sig selv? Forskere ved -
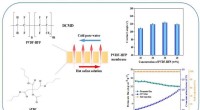 En lovende løsning til at forbedre overfladehydrofobiciteten af hydrofobe membranerKredit:Jun Pan et al., Grænser for kemividenskab og ingeniørvidenskab (2022) Som mange kemikere ved, har membrandestillation (MD) processen vundet stigende popularitet og opmærksomhed for saltvands
En lovende løsning til at forbedre overfladehydrofobiciteten af hydrofobe membranerKredit:Jun Pan et al., Grænser for kemividenskab og ingeniørvidenskab (2022) Som mange kemikere ved, har membrandestillation (MD) processen vundet stigende popularitet og opmærksomhed for saltvands -
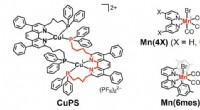 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
 Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
- Lithium-ion batterier Vs. Bly Acid
- Beskriv og forklar forskellen i muskularitet mellem afgrøde -gizzard?
- Dyr ser verden i andre farver end mennesker:Nyt kamera afslører, hvordan det ser ud
- Hvad er en naturlig proces, der kan ændre formen på bjerge langsomt?
- Hvad er årsagen til cirkulær bevægelse omkring jorden?
- Hvordan frigøres kuldioxid fra carbonatklipper ind i atmosfæren?


