Hvordan kan du se, om forbindelsen er molekylær?
Forståelse af molekylære forbindelser
* Definition: Molekylære forbindelser dannes, når to eller flere ikke -metaller deler elektroner gennem kovalente bindinger.
* Karakteristika:
* De har generelt lavere smelte- og kogepunkter sammenlignet med ioniske forbindelser.
* De er ofte gasser, væsker eller bløde faste stoffer ved stuetemperatur.
* De har en tendens til at være dårlige ledere af elektricitet, både i deres faste og flydende tilstande.
Identificering af molekylære forbindelser
1. Undersøg elementerne: Hvis forbindelsen primært er sammensat af ikke -metaller (bortset fra brint, der kan fungere som enten et metal eller et ikke -metal afhængigt af forbindelsen), er det sandsynligvis molekylært.
2. Se efter præfikser i navnet: Molekylære forbindelser bruger præfikser (mono-, di-, tri- osv.) For at indikere antallet af atomer i hvert element i molekylet. For eksempel har kuldioxid (CO₂) præfikset "DI" til at vise to iltatomer.
3. Overvej typen af obligation: Hvis bindingen mellem atomerne overvejende er kovalente (deling af elektroner), er det en molekylær forbindelse.
Eksempler:
* vand (H₂O): Hydrogen og ilt er begge ikke -metaller, og bindingerne er kovalente.
* kuldioxid (co₂): Carbon og ilt er ikke -metaller, og navnet bruger præfikser.
* methan (ch₄): Carbon og brint er ikke -metaller, og bindingerne er kovalente.
Undtagelser:
* Nogle forbindelser, der indeholder metaller, kan også være molekylære, men dette er mindre almindeligt. F.eks. Er kviksølv (II) chlorid (HGCL₂) molekylær på trods af at det indeholder metalkviksølv.
Nøglepunkter:
* Selvom disse metoder generelt er pålidelige, er det altid bedst at konsultere en pålidelig kilde som en lærebog eller en hæderlig websted for specifikke forbindelser.
* Hvis du er usikker, skal du overveje forbindelsens egenskaber (smeltepunkt, ledningsevne) for at hjælpe dig med at klassificere det.
Sidste artikelHvordan beregner du hvor mange iltatomer der er i 2,50 gram gas?
Næste artikelForhold efter antal atomer i merkurøst chlorid?
 Varme artikler
Varme artikler
-
 Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P
Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P -
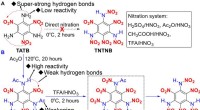 Syntese af TNTNB repræsenterer ny energitop for organiske sprængstofferSyntese af TNTNB.(A) Mislykket nitrering fra TATB til TNTNB ved brug af forskellige nitreringssystemer. (B) Syntese af TNTNB under anvendelse af den foreslåede acylerings-aktiverings-nitreringsstrateg
Syntese af TNTNB repræsenterer ny energitop for organiske sprængstofferSyntese af TNTNB.(A) Mislykket nitrering fra TATB til TNTNB ved brug af forskellige nitreringssystemer. (B) Syntese af TNTNB under anvendelse af den foreslåede acylerings-aktiverings-nitreringsstrateg -
 Uforgængelig virus giver hemmelighed ved at skabe utroligt holdbare materialerPeter M. Kasson, M.D., Ph.d., (til venstre) og Edward H. Egelman, Ph.d., har låst op for hemmelighederne ved en næsten uforgængelig virus, muligvis tillader forskere at udnytte sine bemærkelsesværdige
Uforgængelig virus giver hemmelighed ved at skabe utroligt holdbare materialerPeter M. Kasson, M.D., Ph.d., (til venstre) og Edward H. Egelman, Ph.d., har låst op for hemmelighederne ved en næsten uforgængelig virus, muligvis tillader forskere at udnytte sine bemærkelsesværdige -
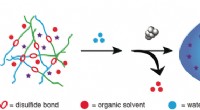 Selvødelagt redox-følsom stomatocyt nanomotor leverer og frigiver lægemidler til cellerKredit:Wiley Autonom målretning og frigivelse af lægemidler på deres virkningssted er ønskede træk ved nanomediske systemer. Nu, et hold hollandske forskere har designet en nanomotor, der har diss
Selvødelagt redox-følsom stomatocyt nanomotor leverer og frigiver lægemidler til cellerKredit:Wiley Autonom målretning og frigivelse af lægemidler på deres virkningssted er ønskede træk ved nanomediske systemer. Nu, et hold hollandske forskere har designet en nanomotor, der har diss
- Hvad menes med opløselighed?
- Hvad er 35 grader nordlig breddegrad og 80 vestlig længdegrad?
- Hvordan husker du de elleve energityper?
- Forskning beskriver langsomt og hurtigt lys i plasma
- Når bølgelængden af spektrale udsendt fra en objektforøgelse, der slutter visiblight -spektret…
- Hvordan blev Leo en konstellation?


