Hvorfor tilsætter du natriumcarbonat til blandingen under fremstilling af ester?
Her er hvorfor:
* Base-katalyseret hydrolyse: Natriumcarbonat er en base. I nærvær af vand kan det katalysere hydrolysen af esteren tilbage i dens tilsvarende carboxylsyre og alkohol, hvilket effektivt vender esterificeringsprocessen.
* Konkurrerende reaktioner: Karbonationen kan reagere med den syrekatalysator (typisk svovlsyre) anvendt til esterificering, danne kulsyre (H₂CO₃), som er ustabil og nedbrydes til kuldioxid (CO₂) og vand. Denne reaktion forbruger syrekatalysatoren og hindrer esterificeringsprocessen.
I stedet for natriumcarbonat bruges følgende ofte under esterificering:
* syrekatalysator: En stærk syre som svovlsyre (H₂so₄) eller saltsyre (HCI) anvendes til at katalysere reaktionen.
* dehydreringsmiddel: Et dehydreringsmiddel, såsom koncentreret svovlsyre, bruges ofte til at fjerne vandet, der produceres under reaktionen, hvilket skifter ligevægt mod esterdannelse.
* vandfri forhold: Reaktionen udføres ofte under vandfri betingelser for at minimere vandets påvirkning på esterificeringsprocessen.
Sammendrag:
Tilsætning af natriumcarbonat til en esterificeringsreaktion kan hindre processen på grund af dens grundlæggende karakter og potentiale til at reagere med syrekatalysatoren. I stedet anvendes sure forhold og dehydreringsmidler typisk for at lette esterdannelse.
Sidste artikelHvad er den glans spaltning hårdhed og farve på klipper?
Næste artikelHvor mange valenselektroner har MG plus 2?
 Varme artikler
Varme artikler
-
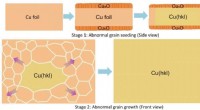 Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere
Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere -
 Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige
Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige -
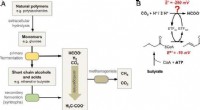 Afgørende trin identificeret i omdannelsen af biomasse til metanKredit:DOI:10.1073/pnas.2111682118 Mikrobiel produktion af metan fra organisk materiale er en væsentlig proces i det globale kulstofkredsløb og en vigtig kilde til vedvarende energi. Denne naturli
Afgørende trin identificeret i omdannelsen af biomasse til metanKredit:DOI:10.1073/pnas.2111682118 Mikrobiel produktion af metan fra organisk materiale er en væsentlig proces i det globale kulstofkredsløb og en vigtig kilde til vedvarende energi. Denne naturli -
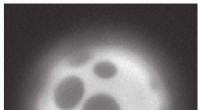 Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
- Når forskere stiller spørgsmål om, hvordan naturen fungerer og forsøger at besvare disse spørgs…
- Hvilken kilde til energi producerer damp?
- Hvad er tilstanden af stof germanium ved 0 grader Celsius?
- Sådan fungerer flyselskaber
- Hvad er alfa-forfaldsligningen for polonium-218?
- Airbus siger, at ukorrekte indstillinger spillede en rolle i Mali-helikopterulykken


