Kovalente forbindelser viser hvilke af disse egenskaber?
Generelle egenskaber:
* Lav smeltnings- og kogepunkter: Sammenlignet med ioniske forbindelser har kovalente forbindelser generelt svagere intermolekylære kræfter (kræfter mellem molekyler), hvilket fører til lavere smelte- og kogepunkter.
* dårlig elektrisk ledningsevne: Kovalente forbindelser er generelt dårlige ledere af elektricitet i både faste og flydende tilstande, fordi de mangler frit bevægende ladede partikler (ioner).
* opløselighed i ikke-polære opløsningsmidler: Kovalente forbindelser, især dem med ikke-polære bindinger, har en tendens til at opløses i ikke-polære opløsningsmidler som kulbrinter.
* findes ofte som gasser eller væsker ved stuetemperatur: På grund af deres svagere intermolekylære kræfter er mange kovalente forbindelser gasser eller væsker ved stuetemperatur.
Specifikke egenskaber:
* Stærke intramolekylære bindinger: Kovalente forbindelser har stærke bindinger i molekylet (kovalente bindinger), men svagere intermolekylære kræfter mellem molekyler.
* Variabel smeltning og kogepunkter: Selvom de generelt er lavere, kan smeltnings- og kogepunkterne variere meget afhængigt af størrelsen og kompleksiteten af molekylerne.
* kan være faste stoffer, væsker eller gasser: Den fysiske tilstand ved stuetemperatur afhænger af styrken af intermolekylære kræfter.
* kan være brandfarlig: Nogle kovalente forbindelser er meget brandfarlige, især dem, der indeholder kulstof og brint (kulbrinter).
* Variabel reaktivitet: Reaktiviteten af kovalente forbindelser afhænger af de involverede specifikke elementer og de tilstedeværende bindinger.
Eksempler:
* vand (H₂O): En væske ved stuetemperatur, godt opløsningsmiddel til polære molekyler, men en dårlig leder af elektricitet.
* methan (ch₄): En gas ved stuetemperatur, brandfarlig, ikke-polær og opløselig i ikke-polære opløsningsmidler.
* sukker (c₁₂h₂₂o₁₁): Et fast stof ved stuetemperatur, opløselig i vand, ikke-ledere af elektricitet.
Fortæl mig, hvis du vil have en mere detaljeret forklaring af en bestemt ejendom!
 Varme artikler
Varme artikler
-
 Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det
Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det -
 Video:Heltinder i det periodiske systemKredit:The American Chemical Society I 1871, Dimitri Mendeleev præsenterede sit periodiske system for verden. Mange af de nuværende 118 elementer manglede, og han efterlod pladsholdere til dem, de
Video:Heltinder i det periodiske systemKredit:The American Chemical Society I 1871, Dimitri Mendeleev præsenterede sit periodiske system for verden. Mange af de nuværende 118 elementer manglede, og han efterlod pladsholdere til dem, de -
 Forskere testede med succes nye, sikrere titaniumplade til knoglevævsreparationDenne røde farvesektion viser, at knoglevæv var kommet ind i rummet mellem titaniumfibre, efter at titanfiberpladen blev implanteret. Grøn farve sektion viser, at i uge 4 postoperativt, fuldstændig kn
Forskere testede med succes nye, sikrere titaniumplade til knoglevævsreparationDenne røde farvesektion viser, at knoglevæv var kommet ind i rummet mellem titaniumfibre, efter at titanfiberpladen blev implanteret. Grøn farve sektion viser, at i uge 4 postoperativt, fuldstændig kn -
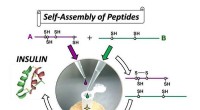 Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
- Et objekt bevæger sig 15,0 m nord og finder derefter 11,0 syd både den kørte afstand på forskydn…
- Kunstig intelligens designer metamaterialer, der bruges i usynlighedskappen
- Hvad er NH2 -funktionel gruppe?
- Hvornår begyndte folk at bruge ikke -vedvarende energi?
- Forklaringen af månens faser
- Solaktivitet rekonstrueret i løbet af et årtusinde


