Har væsker elektrisk ladede partikler?
* elektrolytter: Mange væsker, især dem, der indeholder opløste salte, syrer eller baser, kaldes elektrolytter. Disse stoffer adskiller sig i ioner (ladede partikler), når de blev opløst. For eksempel opløses tabelsalt (NaCl) i vand til dannelse af natriumioner (Na+) og chloridioner (Cl-).
* ioniske væsker: Nogle væsker er udelukkende sammensat af ioner og kaldes ioniske væsker. Disse væsker har ofte unikke egenskaber og bruges i forskellige applikationer som batterier og katalyse.
* polære væsker: Selv rene væsker som vand kan have en lille adskillelse af ladning på grund af den ujævne fordeling af elektroner i deres molekyler. Dette gør dem til polære og i stand til at interagere med ioner.
Det er vigtigt at bemærke:
* Ikke alle væsker er elektrolytter. Rent vand er for eksempel en dårlig leder af elektricitet, fordi det har meget få ioner.
* Tilstedeværelsen og koncentrationen af ladede partikler i en væske bestemmer dens ledningsevne. Væsker med en høj koncentration af ioner er gode ledere af elektricitet.
Sammenfattende, selvom ikke alle væsker er elektrisk ladet, indeholder mange ladede partikler, enten fra opløste stoffer eller deres iboende molekylstruktur.
Sidste artikelAtomreaktion i det indre konverteres?
Næste artikelHvordan kan du øge eller mindske væskens viskositet?
 Varme artikler
Varme artikler
-
 Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig
Fødevareingrediensblandinger mere følsomme over for klimaændringer, undersøgelse finderMauers laboratorieforskning afslører, at fugtsorption i fødevareblandinger er mere følsomme over for klimaændringer end enkelte ingredienser. Kredit:Purdue Department of Food Science foto En nylig -
 Teknologier til enkeltcellet RNA-profilering kan hjælpe med at dissekere de cellulære baser af kom…Alex K. Shalek, en MIT-lektor i kemi, bruger teknologier såsom enkeltcellet RNA-sekventering til at analysere forskelle i genekspressionsmønstre for individuelle celler og til at finde ud af, hvordan
Teknologier til enkeltcellet RNA-profilering kan hjælpe med at dissekere de cellulære baser af kom…Alex K. Shalek, en MIT-lektor i kemi, bruger teknologier såsom enkeltcellet RNA-sekventering til at analysere forskelle i genekspressionsmønstre for individuelle celler og til at finde ud af, hvordan -
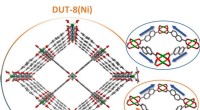 Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er
Ny indsigt i omskiftelige MOF-strukturerSe ind i en MOF-krystal eksemplificeret ved DUT-8. De massive porer kan tydeligt mærkes. Kredit:TU Dresden Metal-organiske rammeforbindelser (MOFer) består af uorganiske og organiske grupper og er -
 Sådan afkøles en smartphonePrøve af materialet. Kredit:NUST MISIS NUST MISIS-forskere har udviklet kompositter, der leder varme mange gange bedre end deres modstykker og endda er genstand for enkel og billig forarbejdning.
Sådan afkøles en smartphonePrøve af materialet. Kredit:NUST MISIS NUST MISIS-forskere har udviklet kompositter, der leder varme mange gange bedre end deres modstykker og endda er genstand for enkel og billig forarbejdning.
- Større Calyces er store grene af nyresøjlen?
- Hvordan forbehandlingsmetoder påvirker omdannelseseffektiviteten af biomasseenergiproduktion
- Hvilke processer bruger ATP som energikilde i skeletmuskelen?
- Data fra tyske politikere er lagt ud på nettet, regeringsundersøgelser kilde
- Hvilket princip siger, at de geologiske processer i dag, der opereres i fortiden?
- Elektronstråle styrker genanvendelig nanokomposit


