Hvad er elektronkonfigurationen af CCL4?
1. Fokus på limning:
* CCL 4 er et kovalent molekyle. Carbonatomet danner fire enkeltbindinger med fire kloratomer.
* For at bestemme elektronkonfigurationen skal vi overveje deling af elektroner i disse bindinger.
2. Lewis -struktur:
* carbon (c): Har 4 valenselektroner (2s 2 2p 2 ). Det skal dele 4 elektroner for at afslutte sin oktet.
* klor (Cl): Har 7 valenselektroner (3s 2 3p 5 ). Hvert klor skal dele 1 elektron for at afslutte sin oktet.
Lewis -strukturen til CCL 4 viser kulstof i midten med fire kloratomer, der omgiver det, hver forbundet med en enkelt binding.
3. Forenklet elektronkonfiguration:
* Da vi har at gøre med et molekyle, kan vi simpelthen sige, at hvert atom i CCL 4 har en fyldt ydre skal Efter binding.
* Carbon har effektivt 8 valenselektroner (på grund af deling) og opfylder octet -reglen.
* Hvert klor har også 8 valenselektroner (på grund af deling), der opfylder Octet -reglen.
Vigtig note: Du kan ikke se en specifik "elektronkonfiguration", som du ville gøre for et atom. I molekyler delokaliseres elektronerne i binding af orbitaler.
Sidste artikelHvordan påvirker tætheden af en væske dens viskositet?
Næste artikelHvad er den specifikke tyngdekraft af eddike?
 Varme artikler
Varme artikler
-
 Ny proces kan styrke 3-D-printede materialer med 200 procentKredit:University of Tennessee i Knoxville Styrken af 3-D-printede produkter kan forbedres gennem en ny teknik udviklet af forskere ved UT og Oak Ridge National Laboratory. Den nye proces, som
Ny proces kan styrke 3-D-printede materialer med 200 procentKredit:University of Tennessee i Knoxville Styrken af 3-D-printede produkter kan forbedres gennem en ny teknik udviklet af forskere ved UT og Oak Ridge National Laboratory. Den nye proces, som -
 Ny flydende-metal-membranteknologi kan hjælpe med at gøre brintbrændselscellekøretøjer levedygt…Fra venstre, Pei-Shan Yen 16 (PhD), Ravindra Datta, professor i kemiteknik, og Nicholas Deveau 17 (PhD) ved Worcester Polytechnic Institute (WPI udviklede nye sandwichede flydende metalmembraner, der
Ny flydende-metal-membranteknologi kan hjælpe med at gøre brintbrændselscellekøretøjer levedygt…Fra venstre, Pei-Shan Yen 16 (PhD), Ravindra Datta, professor i kemiteknik, og Nicholas Deveau 17 (PhD) ved Worcester Polytechnic Institute (WPI udviklede nye sandwichede flydende metalmembraner, der -
 Udvikling af en måde at gøre oxygen injicerbarJarad Mason og hans team har skabt permanent porøst vand, hvilket gør det muligt at opbevare gasser i høje koncentrationer i væsken. Kredit:Kris Snibbe/Harvard Staff Photographer Hvad hvis akutmedi
Udvikling af en måde at gøre oxygen injicerbarJarad Mason og hans team har skabt permanent porøst vand, hvilket gør det muligt at opbevare gasser i høje koncentrationer i væsken. Kredit:Kris Snibbe/Harvard Staff Photographer Hvad hvis akutmedi -
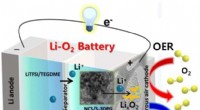 Et frisk pust til længerevarende batterierKatoden er designet til at lette optagelse og frigivelse af ilt, processer, der er nødvendige for afladning og opladning af et litium-luftbatteri. Kredit:DGIST DGIST-forskere forbedrer ydelsen af
Et frisk pust til længerevarende batterierKatoden er designet til at lette optagelse og frigivelse af ilt, processer, der er nødvendige for afladning og opladning af et litium-luftbatteri. Kredit:DGIST DGIST-forskere forbedrer ydelsen af


