Hvorfor væske kan ikke komprimeres til faste stoffer?
* molekylær arrangement: I væsker er molekyler tæt på hinanden, men har større bevægelsesfrihed sammenlignet med faste stoffer. De er ikke stift fastgjort i en gitterstruktur som faste stoffer.
* Intermolekylære kræfter: Væsker har svagere intermolekylære kræfter sammenlignet med faste stoffer. Disse kræfter holder molekyler sammen, men giver dem mulighed for at bevæge sig frit.
* Kompressibilitet: Rummet mellem molekyler i en væske er mindre end i en gas, men de giver stadig mulighed for en vis komprimering. Komprimeringen er imidlertid begrænset af frastødelsen mellem molekyler.
* faseovergange: For at omdanne en væske til et fast stof skal du reducere mellemrummet mellem molekyler markant og øge styrken af intermolekylære kræfter. Dette kræver typisk et fald i temperaturen eller en stigning i trykket.
Kortfattet: Væsker kan komprimeres lidt, men komprimeringen ændrer ikke deres molekylstruktur nok til at omdanne dem til faste stoffer. Du har brug for en betydelig ændring i tryk eller temperatur for at opnå denne faseovergang.
Sidste artikelNavngiv nogle materialer er gode ledere?
Næste artikelHvad er et eksempel på ustabilt atom?
 Varme artikler
Varme artikler
-
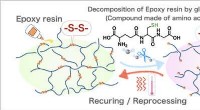 Ny strategi til fremme af genbrug af kulfiberforstærket plastFigur 1:Genbrugssystem af epoxyharpiks med peptidopløsning. Kredit:National Institute for Materials Science Epoxyharpiks er en type termohærdende harpiks, der almindeligvis anvendes i lim, maling
Ny strategi til fremme af genbrug af kulfiberforstærket plastFigur 1:Genbrugssystem af epoxyharpiks med peptidopløsning. Kredit:National Institute for Materials Science Epoxyharpiks er en type termohærdende harpiks, der almindeligvis anvendes i lim, maling -
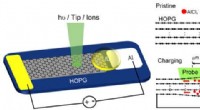 Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de
Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de -
 Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat
Implantatinfektioner kan forvises takket være stilladsgennembrudEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere i Irland har taget et stort skridt fremad i kampen mod medicinske implantatinfektioner. De udviklede en ny type implantat -
 Heterogen katalysator bliver enzymatiskDet var afgørende for denne undersøgelse at designe stedspecifikke enkeltatomkatalysatorer, da denne enkelt-atom struktur direkte efterligner strukturen af enzymer (lavet af enkelte metalatomer og o
Heterogen katalysator bliver enzymatiskDet var afgørende for denne undersøgelse at designe stedspecifikke enkeltatomkatalysatorer, da denne enkelt-atom struktur direkte efterligner strukturen af enzymer (lavet af enkelte metalatomer og o
- Kort gammastråleudbrud efterlader den mest fjerntliggende optiske efterglød, der nogensinde er reg…
- Instagram bremser selvskadende indlæg efter teenagers selvmord
- Supernovaer kunne muliggøre opdagelsen af ny muonisk fysik
- Sådan testes en diodeforstærker
- Hvilken klasse af sedimentære klipper fremstilles fragmenter rockmineraler og skaller?
- Undersøgelse af salte i vand, der forårsager røre


